Заздравителните процеси са характерни за всеки един организъм в живата природа. При тях увредените от действието на различни агенти тъкани и клетки се заместват от нови тъкани клетки. В практиката се използват различни термини, но най-често се говори за регенерация, от латински regeneratio - възраждане. По този начин едновременно със структурата на един орган се възстановява и неговата функция. Регенерацията е приспособителна реакция на организма, изработена в хода на еволюцията, и е присъща на всяко живо същество. При това общата закономерност е че колкото е по-високоразвит един жив организъм или по-високоспециализиран е един орган, толкова по-малка е неговата способност за регенерация - в хода на еволюцията постепенно се губят регенераторните свойства на органи и тъкани. Така например регенераторната способност на сърдечния мускул и нервната тъкан на човека са на практика нулеви, докато един саламандър възстановява изгубения си крайник за около един месец. За толкова време се възстановява и централният резец при плъховете.
Структурно - функционалната специфика на различните органи и тъкани във филогенезата и онтогенезата е различна. При някои органи и тъкани възстановяването се извършва чрез клетъчно делене. Високоспециализираните клетки обаче са изгубили своята способност за делене - при тях се осъществява вътреклетъчна форма на регенерация чрез увеличаване на бров и размерите на ултраструктурните елементи и техните компоненти. Следователно в хода на еволюцията регенерацията не е изчезнала, а е приела друга, вътреклетъчна форма, която е универсална и свойствена за всички органи и тъкани.
С оглед на това че всяка оперативна намеса представлява травма по отношение на организма, е важно всеки хирург да има задълбочени познания по отношение на заздравителните процеси. Същото твърдение е напълно валидно и за общопрактикуващите зъболекари - през последните години много от тях започват да поставят зъбни импланти, а имплантирането на винтов имплант в костните тъкани на челюстите е последвано от бърз или по-бавен заздравителен процес. При наличие на съответните познания и клиничен опит отклоненията в нормалния заздравителен процес могат да бъдат своевременно диагностицирани и при необходимост да се предприемат необходимите лечебни мероприятия.
Организмите се увреждат от много и различни фактори - механични (травматични или ятрогенни, в резултат на оперативна интервенция), физични, химични или биологични фактори, които могат да предизвикат локално увреждане с некроза и загуба на тъкани. Съществува и още един механизъм на увреждане на тъканите - развитие на локална исхемия като следствие от инфаркт (съдова некроза). Безспорно най-опасни са сърдечните и мозъчните инфаркти, но на практика може да се наблюдава локална исхемия при всеки един орган или тъкан в човешкия организъм.
Възстановяването на увредените органи и тъкани може да се осъществи по два начина - пълна и непълна регенерация. Пълната регенерация се нарича още реституция и се осъществява чрез пролиферация на клетките до пълното възстановяване на органа в неговата анатомична и функционална цялост до момента отпреди увреждането. Непълната регенерация пък се изразява в разрастване на клетки от стромата на органа (фибробласти, капиляри и други) и заместване на дефекта от съединителна тъкан. Този начин на възстановяване обаче не води до нормализиране на функцията на органа, тъй като специализираните клетки се заместват от съдинителна тъкан (цикатрикс). При непълна регенерация може да се развие регенераторна хипертрофия - увеличаване на размера на клетките, разположени около зоната на увреждането и съответно на регенерацията. Тя се осъществява, както вече беше споменато, за сметка на вътреклетъчните ултраструктурни елементи. Много показателен пример за това е хипертрофията на кардиомиоцитите около цикатрикс в сърдечния мускул, получен след инфаркт на миокарда. Типът на оздравителния процес, който ще протече в органа или тъканта, се определя от три основни фактора - вида на тъканта и регенераторния капацитет на органа, характера и тежестта на увреждането и промените в екстрацелуларния матрикс. Така например при повърхностни увреждания на кожата може да се стигне до пълно възстановяване чрез регенерация на специализираните епителни клетки; в други случаи заздравителният процес протича изцяло с разрастване на съединителна тъкан, а в трети случаи е налице смесен механизъм - съчетава се регенерацията и на специализирани клетки, и на съединителна тъкан.
Най-подходящ пример за възстановяване при увреждане на органи представлява черният дроб. При нормални условия хепатоцитите са загубили своята способност за делене. При наличие на увреждане обаче те могат да възстановят тази способност и да започнат да се делят. Така например при хепатоцелуларен карцином може да се извърши резекция на част от черния дроб - дори до 80 % от обема му, след което останалите хепатоцити започват да се делят и възстановяват липсващия обем на органа. При чернодробни трансплантации донорът не губи своя черен дроб, а само част от него - което не представлява проблем за живота му и поради това например родители биха могли безпроблемно да бъдат донори за чернодробни трансплантации на своите деца. При масивни зонални некрози на хепатоцитите стромата колабира и на мястото на загинали паренхим разраства съединителна тъкан; при малки, точковидни увреждания, хепатоцитите по съседство започват да се делят и се стига до пълното възстановяване на архитектониката на органа. Най-лошо е положението при хроничен възпалителен процес - тогава от една страна регенерират хепатоцити, като се образуват регенераторни възли, а от друга около тях разрастват фиброзни повлекла, като по този начин се оформя хистопатологичната картина на чернодробна цироза. Основен проблем е разрастването на съединителната тъкан - тя влошава кръвоснабдяването на все повече хепатоцити по съседство, те некротизират и на тяхно място се разрастват нови количества съединителна тъкан. Поради това веднъж започнал, този процес се самоподдържа и продължава все повече и повече напред във времето - това е един показателен пример за това как дори и Природата (а според креационистите - Бог) не е създала съвършена система (човешкия организъм), какво остава за всичко, създадено от човека!
При пълната регенерация специализираните клеткина органа пролиферират и възстановяват напълно липсващата част - както вече стана въпрос. В някои органи клетките достигат края на своя жизнен цикъл, умират, десквамират се и чрез непрекъсната ежедневна пролиферация се заместват от нови, жизнеспособни клетки. Този процес се означава като физиологична регенерация и се осъществява през целия живот на организма. Самите клетки са генетично програмирани за непрекъснато обновяване; пролиферацията им е под строг контрол, като по този начин техният брой остава постоянен. Неприятната ситуация настъпва в момента, в който се нарушат регулаторните механизми - започва непрекъсната, безконтролна пролиферация, което не е нищо друго освен тумор (неопластичен процес). В други органи и тъкани клетките имат по-продължителен живот, незначителна част от тях умират и поради липсата на потребност от нови клетки митози се наблюдават рядко. Поради това колкото по-склонни са клетките на един орган към делене, толкова по-голям е малигненият потенциал на тумора с произход от този орган при евентуалното му възникване. Така например карциномите, които имат епителен произход, в най-общия случай имат доста по-агресивно биологични поведение например от фибросаркомите.
Съществуват доста тъкани, чиито клетки напълно са загубили своята способност за делене и при наличие на увреждане дефектът в тях се замества от съединителна тъкан. Такива са невроните, клетките на напречнонабраздената мускулатура и кардиомиоцитите. В зависимост от растежния потенциал в организмите на бозайниците се наблюдават три типа клетки - лабилни, стабилни и перманентни. При лабилните повече от 1.5 % от всички клетки непрекъснато са в състояние на митоза. Те имат висока пролиферативна активност, при нормални условия се размножават непрекъснато в живия организъм и по този начин заместват завършилите живота си клетки. Лабилни са клетките на лигавиците на дихателните пътища, храносмилателния тракт (включително и устната кухина), пикочните пътища, ендометриума, половите органи, епидермиса, кръвотворните органи и лимфната тъкан. От своя страна тези клетки се делят на два подтипа - унипотентни и плурипотентни. Унипотентните се диференцират само в един тип - например кератиноцитите, които се намират в епидермиса, а плурипотентните е възможно да се диференцират в различни клетъчни типове. Така например една хемопоетична стволова клетка може да се превърне в еритроцит, неутрофил, базофил, моноцит и много други. Стабилните клетки са тези, които имат слаба пролиферативна активност (под 1.5 % от тях са в състояние на митоза при нормални условия) и растежът при тях на практика е спрял. Стабилни са клетките на панкреаса, черния дроб, щитовидната жлеза, слюнчените жлези, епителните клетки в бъбречните каналчета и фиброцитите и остеоцитите (зрелите съединителнотъканни клетки). Стабилни са и гладкомускулните клетки в стената на кръвоносните съдове, както и тези в стената на кухите вътрешни органи. Перманентните клетки нямат способност да се делят - такива са клетките на напречнонабраздената мускулатура, сърдечния мускул и невроните. При загиване на неврони от централната нервна система разрастват съседни невроглиални клетки и се формира цикатрикс също както това се случва по описания по-горе механизъм при инфаркт на миокарда.
При непълната регенерация възстановяването се осъществява чрез разрастване на съединителна тъкан. Обикновено това се получава при загуба на по-голямо количество тъкани - в областта на хирургията това се случва изключително често, тъй като при почти всички оперативни интервенции ятрогенното увреждане прониква под кожата, субдермално и заздравителният процес абсолютно винаги протича с формиране на цикатрикс. В областта на устната кухина кръвоснабдяването е много добро и заздравителните процеси са дори по-бързи от тези при кожни наранявания и оперативен достъп; въпреки това обаче при внимателен оглед също се виждате нежни линеарни цикатрикси на мястото на срезовете. Скоро след приключване на оперативната интервенция започва миграция на фибробласти към оперативното поле; част от тези фибробласти имат контрактилна способност и се наричат миофибробласти. Фибробластната пролиферация се стимулира от тромбоцитния растежен фактор и до голяма степен е зависима от наличието на макрофаги, лимфоцити и интерферон. Ето защо аплицирането на концентрирани растежни фактори в оперативното поле (а в миналото - богата на тромбоцити плазма) силно стимулира оздравителния процес. Поради това и в областта на регенеративната медицина през последното десетилетие навлизат всякакви форми на автогенни растежни фактори.
Фибробластите синтезират и отделят извънклетъчни матриксни компоненти. Те включват фибронектин, протеогликани и колаген тип 1 и 2. Първоначално се секретират фибронектинът и хиалуроновата киселина, а по-късно - сулфатираните протеогликани. Хиалуроновата киселина е силно хидрофилна и това е една от причините за отока на тъканите по време на оздравителния процес - освен наличието на хематом. Поради това и при поставяне на дермални филъри няколко дни след манипулацията се наблюдава оток на мястото на апликацията, въпреки че на практика няма нарушаване на целостта на тъканите. Концентрацията на всички тези компоненти достига максимума си между четвъртия и шестия ден след нараняването, като се нормализира 12 - 13 дни след това. Освен фибробласти се наблюдават и макрофаги, лимфоцити и неутрофилни гранулоцити.
Около 48 - 72 часа след травмата започва пролиферация на кръвоносни съдове в областта. Тя продължава няколко дни, като преминава през няколко фази. Първоначално се понижава концентрацията на ензими в базалните мембрани на съдовете в съседни области. След това започва миграция на ендотелни клетки и тяхната пролиферация. Първоначално се образуват повлекла от ендотелни клетки, в цитоплазмата на които се оформят вакуоли. Впоследствие се оформят капиляри - ендотелните клетки оформят лумени, през които започва да навлиза кръв. Ангиогенезата се регулира основно от действието на фибробластния фактор. Съдовите повлекла анастомозират едно с друго и образуват ново капилярно русло. Прорастващите капиляри образуват гранули над повърхността на раната, които гранули имат яркочервен цвят и именно поради тази макроскопска картина тъканта се нарича гранулационна. По-късно части от новото капилярно русло се диференцират в артериоли и венули; други капиляри не образуват лумен, в тях на започва да тече кръв и те постепенно се резорбират. В най-интензивната фаза от своето развитие гранулационната тъкан има повече капиляри в единица обем от всяка друга тъкан.
Пролиферацията на фибробласти и капиляри са най-значимите начални белези при заздравяването чрез формиране на гранулационна тъкан. Двата процеса - на фибробластна пролиферация и ангиогенеза - са неразривно свързани и взаимно се потенциират. Неадекватната васкуларизация води до слаба фибробластна пролиферация и обратно - при по-бързо прорастване на кръвоносни съдове по-бързо се размножават и фибробластите.
Около 24 часа след нараняването започва и синтезът на колаген в областта. Първоначално се образува колаген тип 3, докато след 7 - 8 дни - основно колаген тип 1, който е и основният тип колаген в цикатриксиалната тъкан. Колагеновите влакна се разполагат успоредно на фибробластите и перпендикулярно на капилярите. С напредването на оздравителния процес се увеличава и количеството на колагена, а намалява това на фибробластите и младите кръвоносни съдове. В резултат на деваскуларизацията, която протича в продължение на няколко седмици, тъканта става по-бледа и се превръща в цикатрикс (ръбец), в който няма съдове или количеството им е минимално. Има голямо количество фиброцити (неактивни фибробласти), много колагенови влакна, основно вещество и фрагменти от еластични влакна.
Образуването на гранулационна тъкан се регулира от действието на различни растежни фактори - ангиогенен, макрофагиален, тромбоцитен, интерферон и хепарин. Заздравяването на дефекти чрез разрастване на гранулационна тъкан и формиране на цикатрикс е полезен и необходим процес по отношение на доброто здравословно състояние на организма, а понякога и за оцеляването му изобщо; това обаче почти винаги е съпроводено от загуба на специализираната функция на органа или тъканта. Също така от философска гледна точка оздравителният процес е живо свидетелство за това как дори и природата (или Бог - според креационистите) не е успяла да създаде нещо съвършено, та какво остава за нас - хората! Това следва да накара много пациенти да се замислят и да нямат свръхочаквания по отношение на резултата от лечението им, което лечение се планира и провежда от техния лекуващ лекар или зъболекар.
Протичането на регенераторните процеси в организма става под строг контрол. Митотичният потенциал на стволовите клетки се определя от взаимодействието на множество фактори. Те оказват влияние между миграцията и специализацията на клетките, ангиогенезата, пролиферацията на фибробластите и множество други процеси. За това спомага и взаимодействието между клетките и екстрацелуларния матрикс; има и множество взаимодействия между клетките, които са разположени една до друга. Така например базалните клетки на епидермиса задържат своето развитие, докато са прикрепени към базалната мембрана; в кожна рана миграцията на клетките от двете страни спира след осъществяването на контакт между тях, след което започва диференциацията им. Очевидно организмът е една фино регулирана и оптимизирана система, която човек все още не може да пресъздаде в пълен мащаб.

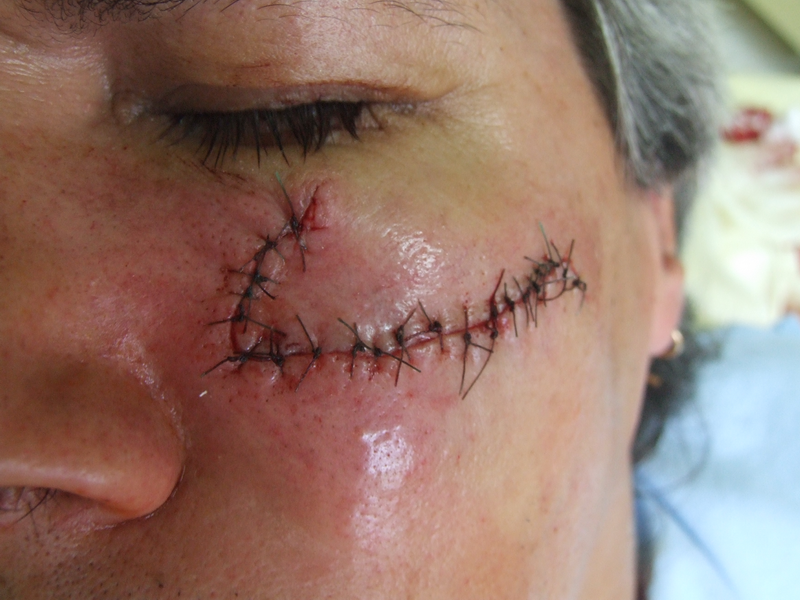
Снимка на болен непосредствено след операция за отстраняване на себацеен аденом на кожата
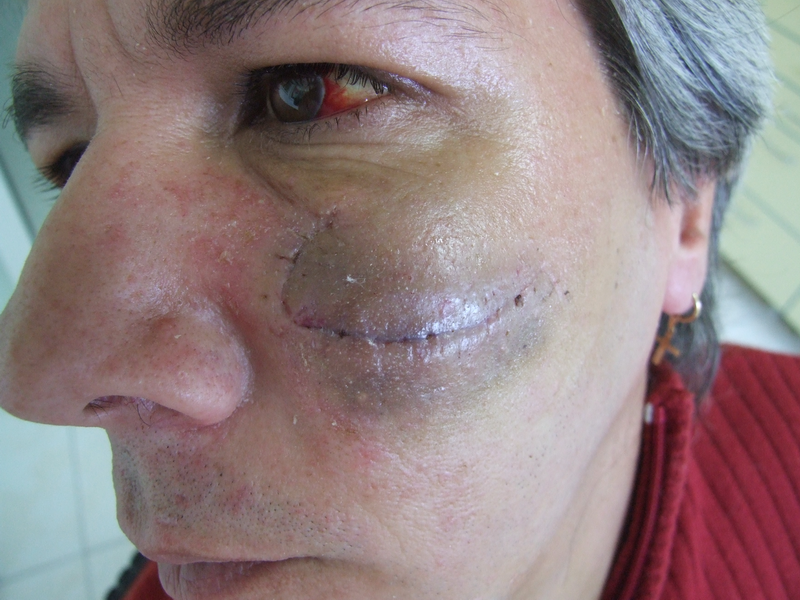
Тежък следоперативен хематом на седмия ден, снимката е направена непосредствено след сваляне на конците
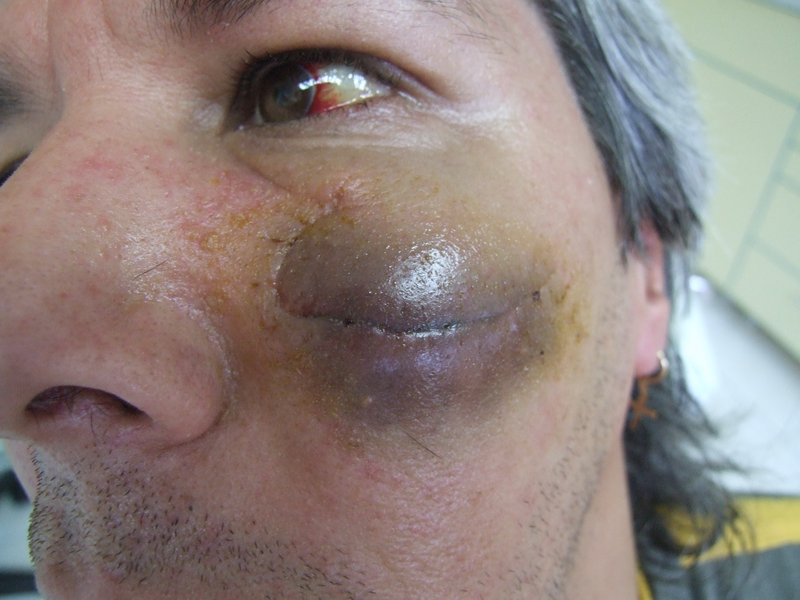
На тази снимка особено ясно се вижда промяната в цвета на хематома - преливания от синьо в жълто
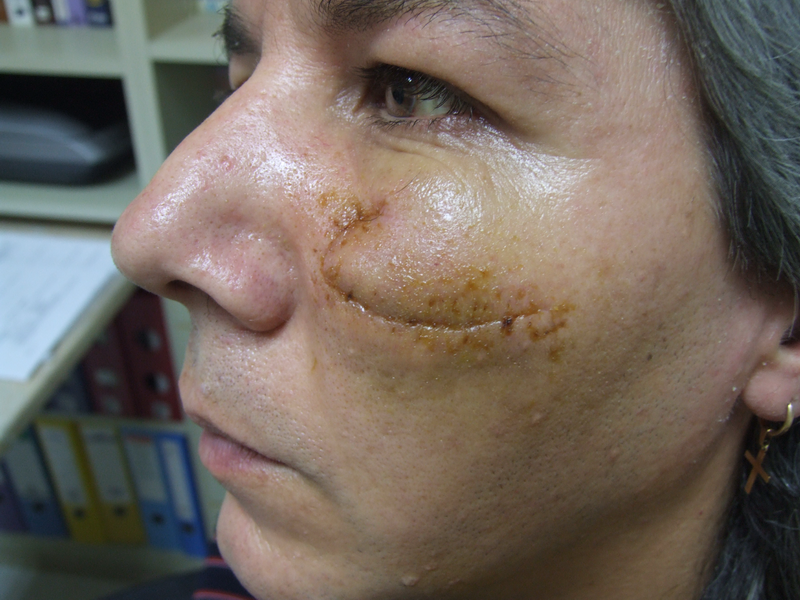
Един месец постоперативно
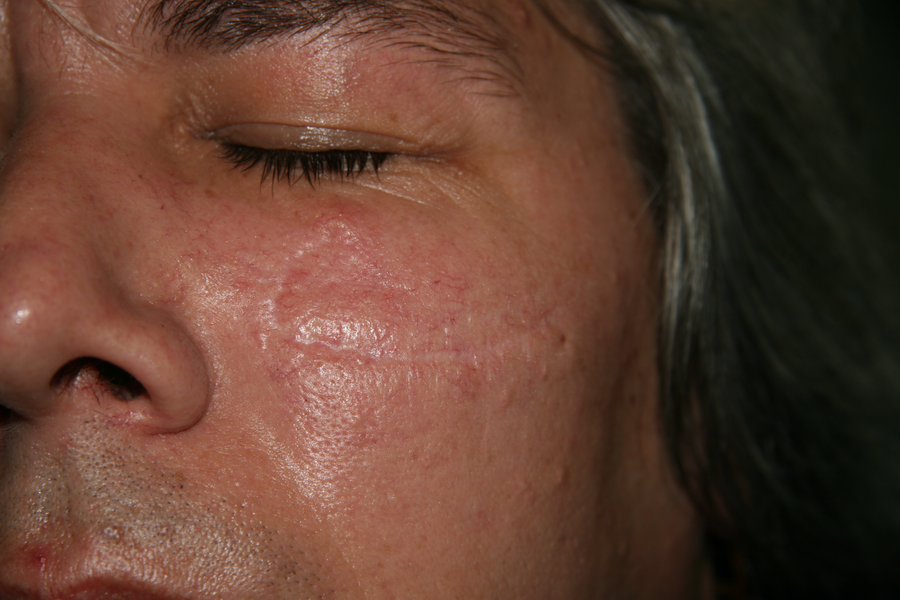
Една година постоперативно
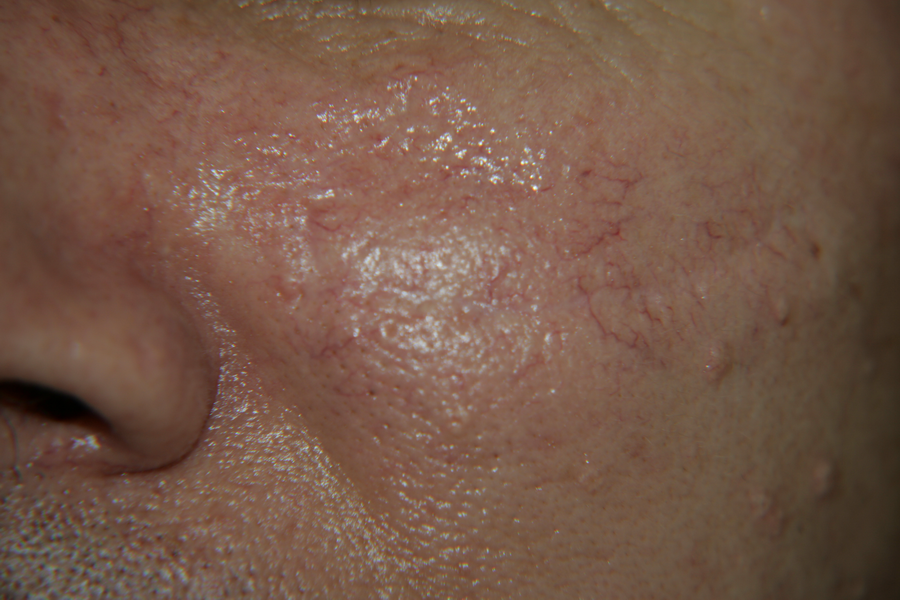
Снимка на същия болен единадесет години следоперативно

Снимка на пациента единадесет години следоперативно от по-голямо разстояние. Обецата на лявото ухо е непроменена - оздравителният процес отдавна е преминал безпроблемно, болестите минават и се забравят, но любовта към рок-енд-рола е вечна!!!
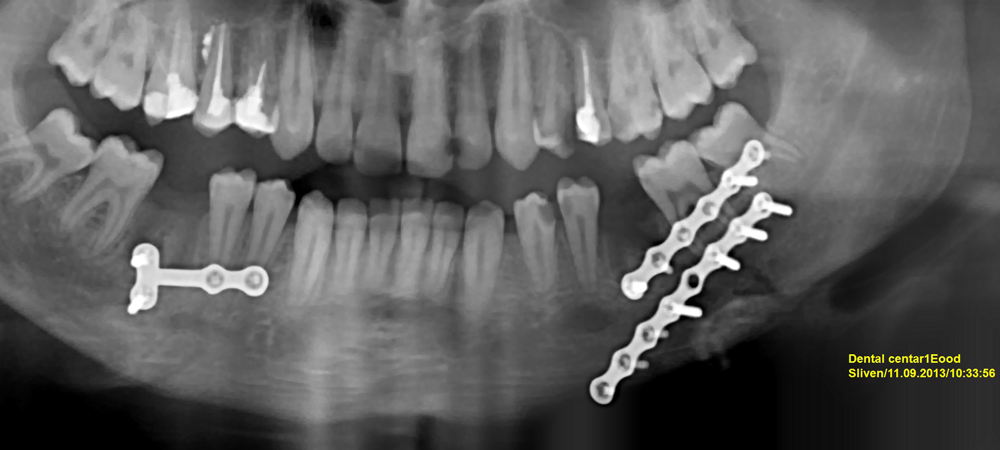
Заздравителен процес при фрактура - ортопантомограма, направена един ден след операцията
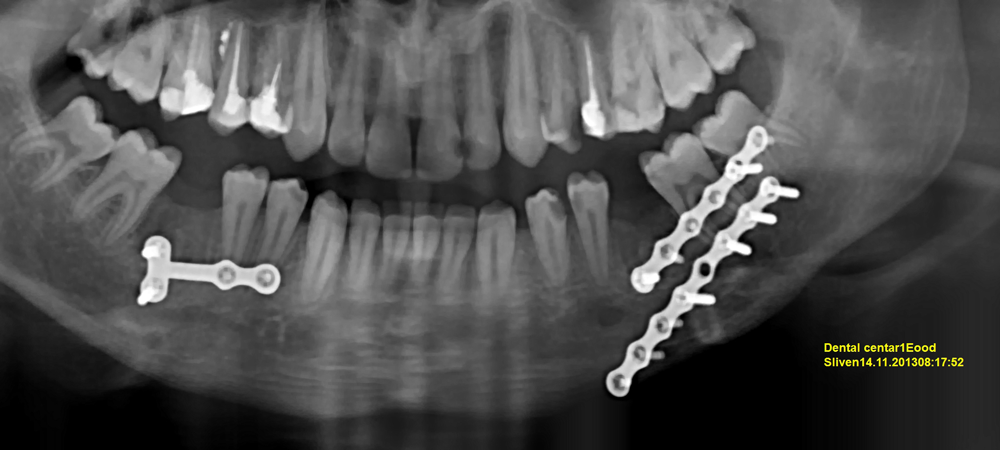
Снимка на същия болен два месеца следоперативно. Фрактурните линии са замъглени, патологична подвижност на фрагментите липсва, оклузията на двете челюсти е без отклонения и пациентът отваря долната си челюст в пълен обем. Всичко това е белег за приключен оздравителен процес, пластините са готови за отстраняване. Костната тъкан с течение на еволюцията си е изградила големи способности за бързо оздравяване - единствено епителът и кръвната тъкан имат по-големи регенеративни възможности. При наличие на фрактурирана кост бързият и безпроблемен оздравителен процес е от критична важност за оцеляването на организма, тъй като фрактурираната кост обездвижва тялото и така животното не може да избяга или да се отбранява - при което оцеляването му става проблематично. Именно поради това костта е изградила значителни способности за спонтанно оздравяване при нарушена цялост на тъканта - счупване. При осигуряване на първична стабилност обикновено само за 35 - 40 дни протича бърз и безпроблемен оздравителен процес; дори и при липса на първична стабилност обаче много често фрактурираните кости заздравяват спонтанно - в природата животните не посещават болници и не се подлагат на оперативни интервенции, а усложненията поради счупванията на костите са изключително редки.
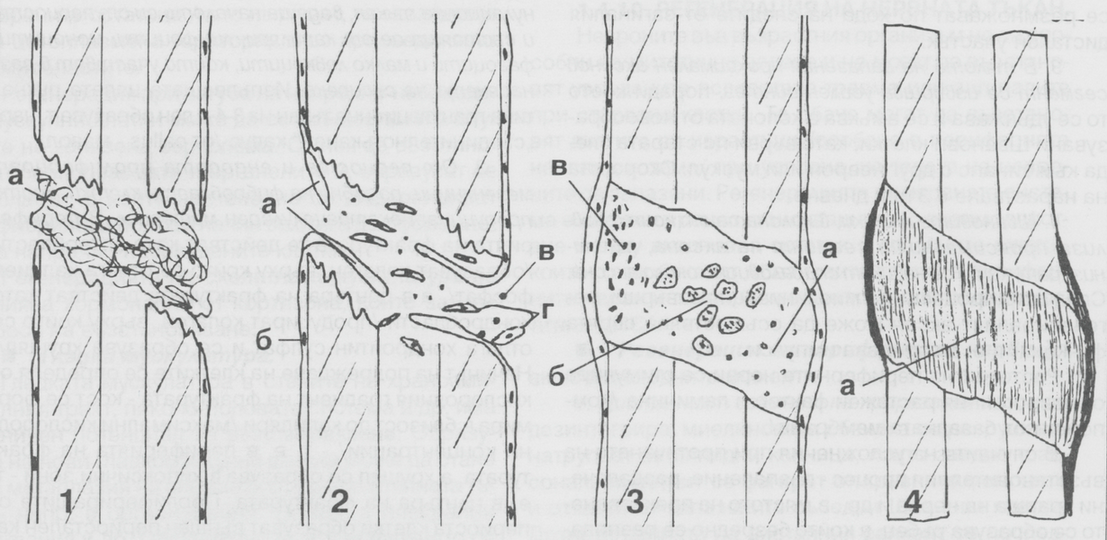
Схема на заздравителния процес в областта на костните тъкани. Костната тъкан има огромни възможности за регенерация - единствено епителът и кръвната тъкан са с по-добри възстановителни способности в организма. Повече информация за костната регенерация можете да прочетете в тази секция на нашия сайт. Оздравителният процес при фрактури е показан на горната схема и протича в няколко стадия: във фаза 1 в зоната на фрактурата се излива кръв от разкъсаните кръвоносни съдове и се образува съсирек, изпълващ мястото между костните фрагменти - на горната схема е означен с буквата а. След това в съсирека започва да прораства гранулационна тъкан, водеща началото си от периоста и състояща се от капиляри, лимфоцити, моноцити и известно количество фагоцити, които участват в разнасянето на съсирека. Изпълващата цялата пукнатина гранулационна тъкан за 3 или 4 дни образува така наречения съединителнотъканен калус (от латински callus - мазол) - фаза 2. Капилярите са означени с а, периостът - с б, моноцитите с в, а мезенхимните клетки с г. От периоста и ендооста пролиферират мезенхимни клетки, които наподобяват фибробласти и продуцират екстрацелуларен материал - фаза 3. В периферията на фрактурата тези клетки действат като остеобласти и образуват колаген, върху който се отлага калциев фосфат. В центъра на фрактурата клетките действат като хондробласти - също продуцират колаген, върху който се отлага хондроитинсулфат и се образува хрущял. Начинът на подреждане на клетките се определя от кислородния градиент на фрактурата - кост се формира в близост до капиляри при висока кислородна концентрация, а хрущял се формира в хипоксичните зони - т.е. в центъра на фрактурата. Пролифериращите от периоста клетки образуват външен периостален калус (бандаж от реактивна тъкан), който имобилизира фрактурата и заедно със съседните мускули и кръвоносни съдове подпомага заздравяването. На горната схема това е показано във фаза 3 - с буквата а е означен прокалусът, който в центъра е изграден от хрущял (б), а периферията - от кост (в).
Хрущялното вещество се вижда на седмия ден след фрактурата под формата на островчета сред съединителната тъкан. Това е временният калус; около 14 дни след травмата пролифериращите остеобласти започват да синтезират остеоид, образуващ протеиновия матрикс на костта. Сред прокалуса се формира безразборна мрежа от остеоидни трабекули, които започват да се импрегнират с калциеви соли. По този начин хрущялният калус се замества от костен калус. Костните фрагменти са здраво свързани, но образуваното костно вещество е в излишък. Около 4 - 6 седмици след травмата то започва да се ремоделира. Резорбцията му се осъществява от остеокластите, като едновременно с това се изгражда нова кост от остеокластите - образува се окончателният калус. След статично натоварване се довършва преустройството на костта, появява се костен мозък, развива се васкуларизация и инервация и настъпва пълно възстановяване. Образуваният в центъра хрущял се дезинтегрира по следния начин - хрущялните клетки продуцират алкална фосфатаза, която предизвиква калцификация на заобикалящото ги вещество. По този начин те се погребват в своеобразни пещери без достъп на кислород и хранителни вещества и постепенно отмират. По същия начин се дезинтегрира и продуцираното от клетките екстрацелуларно вещество. В разградения хрущял прорастват капиляри и остеобласти, които идват от периферията, при което постепенно се замества от здрава костна тъкан.
Някои неблагоприятни условия могат да забавят оздравителния процес при фрактури. Липсата на адекватна имобилизация (много често при клавикула и ребра, но понякога и при долна челюст) води до заместване на съединителнотъканния калус от плътна съединителна тъкан, а не от кост, която съединителна тъкан пречи на по-нататъшното възстановяване. Поради това осигуряването на първична стабилност на фрактурните фрагменти е от ключово значение за протичането на нормалния оздравителен процес при счупени кости. При наличието на инфекция костнтие остатъци поддържат възпалението, което от своя страна забавя регенерацията. Ако краищата на фрактурата са раздалечени един от друг, те остават подвижни, костно - ставният калус не се диференцира в костен и се образува лъжлива става - псевдоартроза. Наличието на добра връзка с околните тъкани (мускули, кръвоносни съдове и сухожилия) е предпоставка за по-бързото и сигурно протичане на оздравителния процес. Ако е налице свръхпродукция на костно вещество, се образуват екзостози, а при по-голямо разрастване на хрущял над фрактурната линия се наблюдават енхондрални осификации.
Недостатъчното набавяне на витамин С и Д с храната също влияе неблагоприятно върху оздравителния процес при фрактури. При такъв хранителен режим се подтиска синтезата на колаген. Неблагоприятни фактори са и недостатъчното количество калциеви соли, йонизиращите лъчения и локалните нарушения в кръвоснабдяването. При фрактури на големите кости в резултат на кръвоизливи могат да се наблюдават усложнения от типа на хиповолемичния шок. Тежко усложнение е мастната емболия, която се получава при попадане на мастна тъкан в кръвния ток. Такива усложнения обаче рядко се развиват при фрактури на челюстните кости - те се налюдават най-вече при счупвания на бедрената кост. В регулацията на костното зарастване участват интерлевкин 1, епидермалният и тромбоцитният растежен фактор. Остеобластите имат доказани рецептори и за трансформиращия растежен фактор алфа, както и за макрофагеалните растежни фактори.
Регенеративните процеси се стимулират от много хормони. Митогенен ефект имат хипофизарните хормони - кортикотропен, тиреотропен, гонадотропен и други. Секрецията от страна на надбъбдречната, щитовидната и други жлези подтиска отделянето на тези хормони по механизма на отрицателната обратна връзка. Ако например се премахне оперативно едната надбъбдречна жлеза, нивото на отделяните хормони в кръвта намалява. Това е пусков момент за отделянето на повишени количества хипофизарен адренокортикотропен хормон. Той стимулира митотичното делене в клетките до момента, в който се образува достатъчно количество нова корова тъкан. Нейните клетки също отделят хормони, които от своя страна водят до намаляване на секрецията на адренокортикотропен хормон.
Някои хормони подобряват регенерацията на неендокринни тъкани. Така например минералкортикоидите влияят върху заздравяването на раните. Половите стероидни хормони поддържат оптималната регенерация на епителните клетки в ендометриума. Хормоните на щитовидната жлеза благоприятстват зарастването на раните, костните фрактури, регенерацията на черния дроб и бъбреците.
Оздравителният процес се стимулира от митогени, които се отделят от неувредени клетки. Пролиферацията и диференциацията на клетки от един тип може да се ускори от продукти на клетки от други типове по съседство. Така например регенерацията на Швановите клетки изисква близко присъствие на фактор от клетъчната мембрана на невроните. Обратно, при срязване на невронален аксон неговото повторно прорастване изисква наличието на Шванови клетки. Пролоферацията на миоцити се стимулира от митогенни фактори, които произлизат от тромбоцитите и моноцитите - по този начин се ускорява пролиферацията на мускулни артериоли и венули при организацията на ексудат. Клетки от същия вид, които са разпаднати, също отделят продукти, стимулиращи митозите - при некроза например се освбождават белтъчни и плазмени съставки, които имат силен митогенен ефект върху клетки от същия вид. По този начин организмът получава сигнал - има налична увредена тъкан, която трябва да бъде възстановена, и съседните клетки започват да се делят.
Клетъчните агрегати инхибират митозите. При непосредствена близост между тези клетки митозите се подтискат - това е установено през 1976 година от W.S. Bullough. Клетъчните медиатори, които подтискат митозите, се наричат халони (от chalao - забавям) и не са напълно проучени. Те действат на малко разстояние от повърхността, от която водят началото си, и контролират клетъчната пролиферация по механизма на обратната връзка. При смърт на клетките изчезват и халоните, което води до начална пролиферация на клетки в съседните участъци - вече липсват халони и няма кой да подтиска митозите в тях. Така пролиферацията продължава до образуването на достатъчно количество клетки, съответно халони, които отново подтискат митозите. Халоните притежават тъканна, но нямат видова специфичност - например епидермалните халони контролират растежа в кожата, стомашно - чревния тракт, потните и млечните жлези, ендометриума и други. В стабилните клетки (на черен дроб, бъбреци) концентрацията на халони е висока, поради което там рядко се среща митотична активност. Обратно, при лабилните клетки (например тези на епитела) кличеството им е малко, поради което те непрекъснато се делят. При кръвоизлив се задейства деленето на еритробластите, за да се възстанови количеството загубени червени кръвни клетки.
Контактната инхибиция на митози в клетките може да бъде предизвикана и от физични фактори - промяна в температурата на средата, формиране на електрически заряд по повърхността на мембраните и други. Плътността на клетките също има значение - когато броят на слоевете в епидермиса достигне определен предел, митотичната активност спира.
Съществуват данни за това че в някои случаи при висока концентрация на продукти от клетъчния обмен в кръвта се инхибират митозите при други клетки от същия тип по механизма на отрицателната обратна връзка. Когато концентрацията на тези продукти в кръвта се понижи (при намален брой на клетките или функционална неадекватност) се снижава и митозоинхибиращият ефект. Започва делене, при което отново се повишава количеството на клетките и съответно обменните продукти се повишават. Тези обменни продукти играят ролята на описаните по-горе халони; особено силно изразен е ефектът им при кръвоизлив, при което много бързо започва еритробластна пролиферация и се синтезират голямо количество еритроцити.
Описани са и голям брой антимитотични цитокини. Към тях спада трансформиращият растежен фактор бета, който е изолиран от левкоцити, лимфоцити, макрофаги, тромбоцити и ендотелни клетки. Инхибира пролиферацията на гладкомускулните клетки и фибробластите. Има негативен ефект по отношение на размножаването на епителните клетки, поради което много често се прилага за подтискане на чернодробната регенерация след хепатектомия. Хепаринът и неговите производни са полизахариди, които освен всичко останало имат и инхибиращ ефект по отношение на митозите. Интерферон алфа подтиска пролиферацията на фибробластите, гладкомускулните и някои неопластични клетки.
В заключение е необходимо да се отбележи че независимо от голямото разнообразие от фактори винаги се осъществява един от двата заключителни ефекта - подтискане или стимулиране на пролиферацията на клетките, а като следствие и на тъканите на организма. Това се нарича принцип на антагонистичната регулация и се регулира фино от много биологични системи; при силно подтискане на пролиферацията и съответно на оздравителния процес започват различни атрофични процеси, а обратно, при нейното прекалено стимулиране се развиват неоплазии.
Все още не са напълно изяснени факторите, които имат отношение към отключване на момента на пролиферацията при възстановяване на кожен или лигавичен дефект. Ангиогенезата се стимулира от ниската кислородна концентрация в съсирека. Установено е че капилярите прорастват в посоката, в която има най-малко кислород. Тя се стимулира от действието на митогенни фактори - например фибробластен растежен фактор. Пусков момент за епидермалната пролиферация представлява загубата на митозосупресиращи халони; определена роля играят и тромбоцитните митогени. Кръвта, която се излива в раната, задейства фибробластната пролиферация. При подреждането на епителните клетки в нормалните им слоеве и изчезването на екстравазалната кръв оздравителният процес приключва под действието на механизма на отрицателната обратна връзка, описан по-горе.
Заздравителният процес се повлиява от множество фактори от общ и локален характер. Чистата рана заздравява значително по-бързо и с по-малко усложнения от раната с неправилни ръбове и участъци с некроза. По-бързо заздравяват малки рани и такива, разположени в области с голямо количество кръвоносни съдове - така например рана на лицето заздравява много по-бързо от рана на стъпалото. Прикрепването към костна повърхност предпазва от разместване на костните ръбове и благоприятства оздравителния процес - например рани на тибията и по билото на алвеоларния гребен на челюстите заздравяват доста бързо. Местното кръвоснабдяване оказва значително влияние върху заздравяването - при пациенти с разширени вени на долните крайници или запушване на аферентен артериален съд процесът протича доста по-бавно и трудно. Прибавената инфекция забавя заздравяването или го спира напълно. Ранното раздвижване има и стимулиращ, и инхибиращ ефект по отношение на заздравителния процес - от една страна дозираното механично натоварване може да ускори оздравяването, но от друга при предозиране много бързо се стига до патологично претоварване с опасност дори от некроза. Абсолютният покой през първите три дни има само положително въздействие; важно условие за безпроблемното протичане на заздравяването е осигуряването на адекватна първична стабилност на тъканите независимо от типа им. Йонизиращата радиация води до съдови лезии, които нарушават кръвоснабдяването и забавят оздравяването. Освен това се подтиска или блокира клетъчната пролиферация, образуването на гранулационна тъкан и контракцията на раната. Действието на ултравиолетова светлина и особено стимулацията с диоден лазер ускорява процесите на заздравяване.
Общите фактори, които оказват влияние, са много и разнообразни. Сърдечната недостатъчност води до нарушено кръвообръщение в целия организъм и това също забавя заздравяването. Инфекциозните заболявания консумират ресурсите на организма и това също има неблагоприятен ефект. Нарушеният в метаболизма (например диабет) създават възможност за допълнително инфектиране на раната; същото важи и за непълноценното хранене. Редица лекарствени средства и хормони оказват съществен ефект - глюкокортикоидите и други стероидни хормони забавят оздравителните процеси, а тироксинът, андрогените и естрогените го ускоряват.
Както при всички процеси в човешката физиология, и при оздравяването може да се наблюдават различни отклонения от обичайния ход и усложнения. При невъзможност за образуване на екстрацелуларен матрикс се наблюдава лошо оформяне на белега - формата му е неправилна, придърпва и деформира околните меки тъкани. Отварянето на оперативната рана (дехисценция) е особено неприятно усложнение във всяка една област на тялото. При коремни операции се наблюдава при около 0.5 - 5 % от всички случаи по литературни данни, като при 30 % от дехисценциите се стига до смърт на болния. В лицево - челюстната хирургия при отваряне на раната много рядко пациентът умира (може би единствено при лимфни дисекции), но опасностите са налице. В областта на имплантологията дехисценциите са също толкова неприятно усложнение - там е важен лечебният подход, тъй като той е от съществено значение за изхода от операцията. Никога не бива да се шие повторно рана, която се е отворила след поставяне на зъбни импланти. Най-адекватно е консервативното лечение - почистване на оперативното поле, локална апликация на антисептици, физиотерапия и най-вече облъчване с диоден лазер с малка мощност.
Улцерация се наблюдава при нарушения на кръвообръщението и недостатъчна васкуларизация на оперативното поле. Типични са улцерациите при рани на крайник с варици или атеросклеротични промени. Трофични или невропатични улцерации се наблюдават при болни с увреждания на гръбначния стълб при сифилис или проказа.
Свръхобразуването на ръбцова тъкан се развива в случаите на прекомерно отлагане на екстрацелуларен матрикс или колаген в областта на раната. Формира се хипертрофичен, туморовидно разрастнал и зачервен цикатрикс, наречен келоид. По повърхността му се срещат изобилни, големи и неправилно разположени колагенови снопчета и много повече капиляри и фибробласти от нормалното количество за възрастта на пациента.
Процесът на намаляване на размера на раната може да бъде ускорен, при което се формира контрактура, съпроводена от силна деформация на раната и тъканите, които я заобикалят. Най-значително се контрахират области, в които при нормални условия има минимално свиване - длани, стъпала, предна стена на гръдния кош. Тежко усложнение са контрактурите, които се развиват след кожни изгаряния от втора или трета степен. Контрактурата може да е толкова изразена, че да блокира стави и естествени отвори - например да се развие стриктура на хранопровода след поглъщане на изгарящи химични вещества.
Свръхмерната пролиферация на гранулационна тъкан по своя клиничен изглед много прилича на келоида. Формират се гранулации, които изпъкват над повърхността на раната и околната кожа, които пречат на нормалния процес на епителизация. Излишната гранулационна тъкан в миналото се е наричала мъртво месо, макар че по своята същност е точно обратното - прекалено витална тъкан, отлично кръвоснабдена и с множество митози. В някои случаи се налага ексцизия или електрокаутеризация на гранулациите, за да се даде възможност за протичане на нормалната епителизация.