В историята на цялата хуманна медицина има три нововъведения, които водят до коренна промяна на начина на работа на медиците, до драстично подобрение в успеваемостта на всяко едно лечение, както и до подобряване на качеството на живот на пациентите и удължаване на продължителността на живота на всички хора като краен резултат. Тези нововъведения са общата анестезия и антисептиката и антибиотичната терапия. Докато първите две иновации са били въведени през XIX век, то антибиотичната терапия започва да се прилага през 1928 година със синтезата на първия антибиотик (пеницилин) от Александър Флеминг. През 1930 година започва приложението на сулфонамидите; през 1940 - на аминоглюкозидите. През 1950 година са открити холарамфениколът, тетрациклиновите антибиотици и макролидите, а през 1960 - хинолоните и линкозамидите. През 1970 година в практиката е въведен триметоприм, след което едва през 2000 година има открити две нови групи - липопептиди и оксазолидинони.
Антибиотиците спадат към групата на химиотерапевтичните средства. Те са продукти от метаболизма на различни гъбички и бактерии или представляват полусинтетични и синтетични аналози на тези продукти. Антибиотиците спират размножаването на микроорганизмите (бактериостатичен ефект) или ги разрушават (бактерициден ефект). В настоящата обзорна статия ще разгледаме всички описани досега антибиотици, въпреки че www.maxillofacial-bg.com е уеб-проект, концентриран най-вече в областта на лицево - челюстната хирургия.
Според произхода и химичната структура антибиотиците се делят на:
I. Бета - лактамни антибиотици
Пеницилини - биосинтетични, бета-лактамазоустойчиви изоксазолилпеницилини, широкоспектърни аминопеницилини и протектирани широкоспектърни пеницилини
Цефалоспорини - от първо, второ, трето и четвърто поколение
Карбапенеми
Монобактами
Карбацефеми
II. Небета - лактамни антибиотици
Аминоглюкозиди
Тетрациклини
Амфениколи
Макролиди
Линкозамиди
Полимиксини
Гликопептидни антибиотици
Рифамицини
Антибиотици с различна химична структура
III. Синтетични антибактериални средства
Хинолони - налидиксова киселина и аналози, флуорхинолони
Синтетични антимикобактериални лекарства - противотуберкулозни и антилепрозни средства
Сулфонамиди - с кратко действие, със средно продължително действие, депо - сулфонамиди, сулфонамиди със слаба чревна резорбция, комбинирани с триметоприм сулфонамиди и сулфонамиди с антиулцерозна активност
Производни на оксализидонона
Оксихинолони - ентероантисептици, уроантисептици и вагинални антисептици
Нитрофурани - ентероантисептици и уроантисептици
Фармакокинетиката на антибиотиците е от решаващо занчение относно приложението им при всякакви инфекции. Според чревната резорбция се различават препарати с незначителна резорбция, добра резорбция и много добра резорбция. С незначителна резорбция са аминоглюкозидите и полимиксините; с добра резорбция на празен стомах са ампицилинът, еритромицинът и линкомицинът - те достигат резорбция около 40 - 50 %. Съществуват и препарати с много добра резорбция - амоксицилин, хлорамфеникол, флуорохинолони. Те достигат резорбция над 75 %. Според проникваемостта в ликвора има препарати с добра проникваемост дори при здрави менинги, такива с добра проникваемост при увредени менинги и такива със слаба проникваемост в менингите (дори и при увредени менинги). Значителна слюнчена секреция имат ровамицин, олеандомицин и йозамицин; от значение е и уринната и жлъчната секреция на антибиотиците - желателно е при уроинфекции и жлъчни инфекции да се прилагат препарати, които имат съответната фармакокинетика. Някои препарати са с по-дълъг период на плазмен полуживот, поради което се прилагат само два пъти на денонощие или дори еднократно. Така например цефуроксим (Zinnat), рокситромицин, метациклин, флуорохинолоните и ко-тримоксазолът се прилагат двукратно; еднократно се дават депо-сулфамиди, доксициклин, цефтриаксон.
Съществуват някои особености във фармакодинамиката на антибиотиците, които са от значение за начина на тяхното приложение. Съществуват пепарати, подтискащи синтезата на бактериалната стена - такива са бета-лактамните антибиотици, ванкомицинът, етамбутолът и др. Други препарати подтискат белтъчната синтеза в микробната клетка, трети повишават пропускливостта на бактериалната мембрана (полимиксини), четвърти подтискат синтезата на нуклеиновите киселини или фолиевата киселина (сулфонамиди). Според спектъра на действие се различават широко- и тясноспектърни антибиотици.
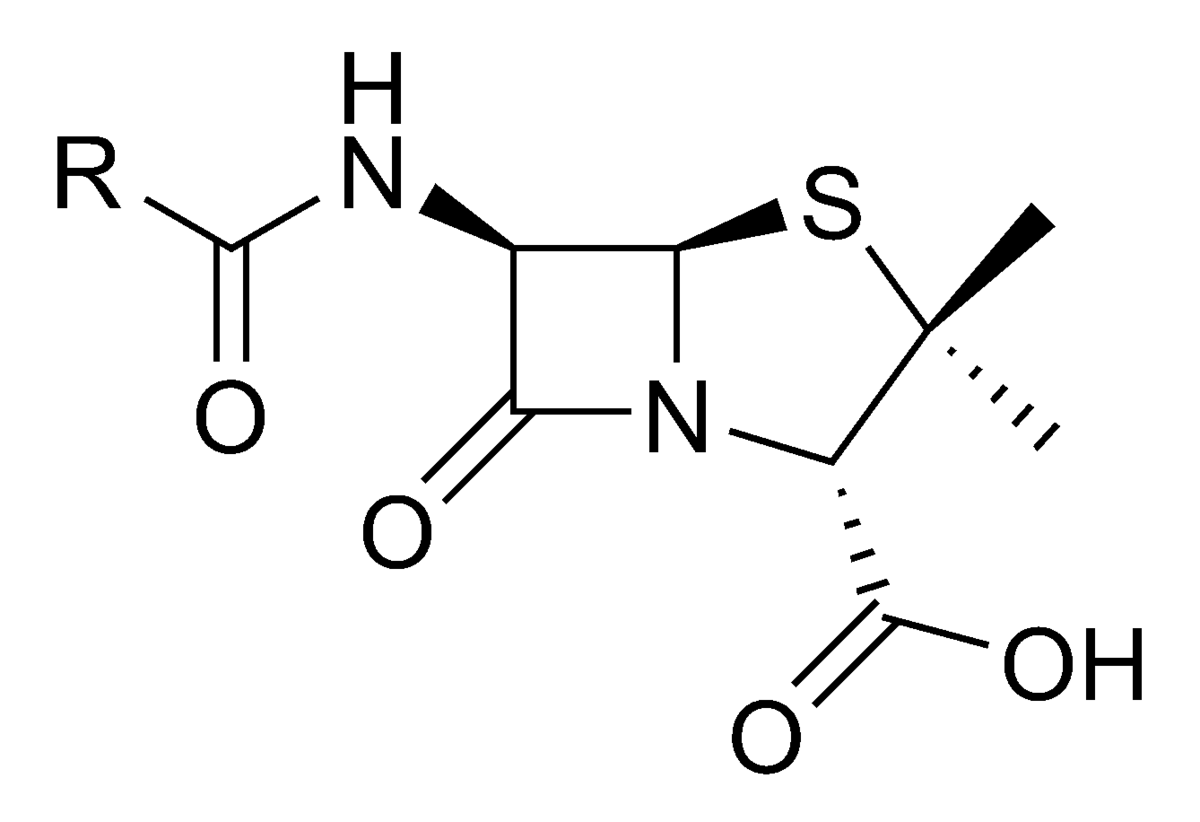
Най-общо бета - лактамни антибиотици са пеницилините и цефалоспорините. Те съдържат в молекулата си бета-лактамен пръстен, откъдето идва и названието им. Микроорганизми, които са устойчиви на действието им, продуцират ензима бета-лактамаза, който разкъсва пръстена и като следствие молекулата на антибиотика става неактивна.

Химична структура на бета-лактамния пръстен
Пеницилините са първите въведени в практиката антибиотици. Като химични съединения са производни на 6-аминопеницилановата киселина. Подтискат синтезата на мукопептида муреин в бактериалната стена и поради това имат бактерицидно действие – под тяхното действие настъпва бърза бактериолиза. След свързване със специфични протеини в бактериалната стена (пеницилинсвързващи протеини или PBPs) активират и някои автолитични ензими в стената. Поради това пеницилините действат повече при активно размножаващи се микроорганизми. Същевременно се отличават с ниска токсичност и голяма терапевтична ширина. Основните странични ефекти на пеницилините са проявите на свръхчувствителност. Честотата на алергичните реакции е от 1 до 10 %. Наблюдават се кожни обриви, ринит, ангионевротичен оток, астматичен пристъп, анафилактичен шок. Последният е най-рядък (с честота 0,05 %, според други автори - 1/100 000 инжектирания), но завършва със смърт в 10 % от случаите. Като странични ефекти на антибиотиците от пеницилиновата група са описани серумната болест и хемолитичната анемия.
Карцином на долната устна Папилом на горната устна Интернет
Сепсис Антибиотици в имплантологията Орална хирургия Имплантатна система Neobiotech
Местно дразнещото действие на пеницилините е причина за болезненост на мускулните инжекции и менингорадикулерно дразнене. При много големи дози бензилпеницилин е възможно да се проявят невротоксични ефекти - менингорадикулерно дразнене и епилептиформени гърчове - при дози от 40 млн. UI венозно и над 10 000 UI лумбално. Рискът е по-висок при увредена хемато - енцефална бариера (при менингит или епилепсия) и при нарушена бъбречна функция. Мегатерапията с пеницилини крие и потенциален риск от възникване на ендотоксичен шок (реакция на Jarisch - Hexheimer), което налага задължителното включване на кортикостероиди като профилактика на тези реакции. Ако бензилпеницилинът се прилага под формата на калиева сол, може да се развие хиперкалиемия и поради това при високи дози винаги се използва натриевата форма. При продължителна орална терапия с широкоспектърни пеницилини са възможни ендогенни суперинфекции - с причинители кандида, стафилококи или анаероби. Мускулните инжекции с пеницилин са болзнени, а и съдовото инжектиране крие рискове. При венозно инжектиране най-вече на депо-пеницилини съществува риск от синдром на Hoigne - микроемболии в капилярите на мозъкаи белия дроб, клинично проявяващи се с кашлица, стенокардни пристъпи и световъртеж, халюцинации и парестезии. При артериално попадане на препарата се развива синдром на Nicolau - артериална емболия, проявяваща се с исхемия в областта дистално от зоната на инжектиране.
В практиката се прилагат няколко групи пеницилини, които са изброени по-долу.
Тук спада Benzylpenicillin (Penicillin G) – fl. 500 kUI, 1, 4 и 5 MUI. Прилага се парентерално, тъй като бързо се разгражда от стомашния сок. Активен е спрямо грам – положителни микроорганизми, освен ако няма естествена или придобита резистентност (според някои изследвания резистентни към пеницилин са 60 – 70 % от стафилококите). Прилага се в дози 3 – 24 MUI / 24 часа, разделени на 4 приема интрамускулно или интравенозно. При особено тежки инфекции,
септични състояния и т.н. практически няма горна граница за дозата на пеницилина – прилагат се дози дори от порядъка на 200 MUI / 24 часа. При новородени и малки деца дневната доза е по 100 000 UI / kg, при тежки инфекции - до 400 000 UI / kg, разделена най-добре на 6 апликации през 4 часа. Други препарати от тази подгрупа са оралните пеницилини и депо-пеницилините. Към оралните спадаm Phenocillin (tab. 150 и 200 mg), Phenoxymethylpenicillin (Ospen - filmtab. 500, 1000 и 1500 kUI), Propicillin, Pheniticillin, Azidocillin. Към депо-пеницилините спада Benzacillin (Benzathyn – penicillin). Той се доставя във флакони 600 и 1200 kUI, прилага се мускулно един път седмично или веднъж на две седмици. При абсцеси и флегмони не намира широко приложение, прилага се повече при хронични инфекции
Пеницилиназа - устойчиви тясноспектърни полусинтетични пеницилини
Kъм молекулата на 6-аминопеницилановата киселина на тези препарати е добавена пречеща странична верига с полярен характер. Тя защитава бета-лактамазния пръстен от пеницилиназата (най-честата бета - лактамаза, произвеждана от микроорганизмите). Към тази група се отнасят две допълнителни подгрупи, които се класифицират единствено според химичния си състав.
Група на метицилина
Тук е включен единствено препаратът Methicillin, който се предлага само във флакони от 1 g. Той обаче има изразена нефро- и миелотоксичност, поради което намира все по-рядко приложение в ежедневната клинична практика.
Изоксазолилпеницилините се характеризират с по-висока активност и по-добра резорбция. Тук спадат антибиотичните препарати Oxacillin – fl. 0,5 g, Cloxacillin – caps. 250 и 500 mg, Flucloxacillin – caps. 250 и 500 mg, Dicloxacillin – caps 250 и 500 mg и Nafcillin). Оксацилинът се прилага орално в доза 500 – 1000 mg през 6 часа; при тежки инфекции дозата му може да достигне до 6 g / 24 часа. Клоксацилинът се прилага перорално в капсули по 250 или 500 mg на 6 или 8 часа до обща доза 2 – 4 g / 24 часа. Флуклоксацилинът се дава в доза 3 – 4 табл. по 500 mg / 24 h.
Тази подгрупа се прилага широко при лечение на абсцесите и флегмоните в лицево - челюстната област. Тук спадат Ampicillin, Amoxicillin, Epicillin, Bacampicillin, Pivampicillin. Ампицилинът се прилага по-често парентерално, тъй като при перорален прием е възможно да предизвика ерозии на стомашната лигавица. Дневната му доза е от 4 до 12 g, при деца – 100 – 400 mg/kg. Амоксицилинът е по-устойчив на действието на киселините и има по-добра чревна резорбция от ампицилина, поради което се прилага по-често перорално. Освен това добре прониква в гнойни секрети и не се разгражда в тях. Денонощната му доза достига 2 g, при деца – 100 mg/kg. Бакампицилин (tab. 400, 600, 800 mg) има бърза и ефективна резорбция – една таблетка от 400 mg дава същата плазмена концентрация като 1 g ампицилин, приет орално. Прилага се в дневна доза 0,8 – 1,2 g. При септични състояния се прилагат 2 - 4 g, които се равняват на 6 g ампицилин, приет парентерално, т.е. Bacampicillin се отличава също с висока активност.
Към тях се отнасят Carbenicillin (fl. 1 g за i.v. или i.m. приложение в доза 3 – 6 g на 6 часа), Ticarcillin (fl. 1 g, прилагат се също i.v. или i.m. в доза 3 – 6 g / 6 часа), Temocillin (fl. 500 mg, 1 и 2 g, дава се по 2 – 4 g / 24 h) и Carinadacillin. Карбеницилинът показва добра активност срещу грам-отрицателната флора, но засилва риска от кървене при прием на орални антикоагуланти. Възможни са нарушения във функциите на тромбоцитите с удължаване на времето на кървене.
Тук се отнасят Azlocillin (Securopen – fl. 0,5; 1 и 2 g, прилагат се 1 – 3 g / 6 часа), Mezlocillin (Baypen – fl. 0,5; 1, 2 и 5 g), Piperacillin (fl. 1, 2 и 4 g, дава се по 6 – 12 g / 24 h), Apalcillin, Furazlocillin, Pirbencillin. Тези антибиотици също са активни срещу грам-отрицателната флора, повлияват добре и анаероби. Имат добър ефект при имоносупресирани болни.
Към тях спадат Pivecillinam (tab. 200 mg, дава се 3 по 1 – 2 таблетки дневно) и Miraxid (комбинация от Pivmecillinam 200 mg + Pivampicillin 250 mg). Toва са нова група антибиотици с широк спектър и висока ефективност.
Това представляват комбинирани препарати, съдържащи широкоспектърен пеницилин и инхибитор на бета-лактамазите (клавуланова киселина, сулбактам и др.). Комбинацията от амоксицилин и клавуланова киселина (Amoxiclav, Augmentin) е общоприета и рутинно прилагана. При препарата ко-амоксиклав е описан флебитогенен ефект. Други комбинирани препарати са Timentin (тикарцилин + клавуланова киселина) и Unasyn (ампицилин + сулбактам).
Цефалоспорините също като пеницилините съдържат в молекулата си бета-лактамен пръстен. Изолирани са през 1948 г., но природните цефалоспорини не са намерили широко приложение. Днес се използват полусинтетични цефалоспорини, производни на 7-аминоцефалоспорановата киселина. По своята структура се отличават от пеницилините по това, че вместо тиазолидинов съдържат дехидротиазинов пръстен, кондензиран с бета-лактамния. Имат и подобен на пеницилините бактерициден механизъм на действие, но за разлика от тях всички цефалоспорини са широкоспектърни. Те са по-малко чувствителни по отношение на бета-лактамазите. Екскретират се предимно с урината, но някои от тях - и с жлъчката. Такива са цефазолин, цефамандол, цефотиазон и цефтриаксон. Имат местен дразнещ ефект, предизвикват алергични реакции (но с по-ниска честота от тази при пеницилините – около 1 - 4 %), подтискат синтезата на витамин К – зависимите фактори на кръвосъсирването и поради това нарушават функцията на тромбоцитите. Във връзка с това се прилагат ограничено при съответните рискови болни или се комбинират с витамин К. Описана е известна нефротоксичност, както и преходно повишаване на аминотрансферазите и алкалната фосфатаза в серума, понякога положителен тест на Coombs. Алкохолна непоносимост (дисулфирам реакция) се наблюдава понякога при терапия с цефамандол и цефоперазон. Възможни са псевдоположителни реакции за глюкоза в урината с меден редуктазен тест, но не и с ензимен тест. Псевдоотрицателна реакция се наблюдава с ферицианидния тест за наличие на глюкоза в кръвта. Не се прилагат цефалоспорини през първите три гестационни месеца и по време на кърмене.
В практиката се прилагат четири поколения цефалоспорини, описани по-долу.
Първо поколение цефалоспорини
Тук спадат голям брой лекарствени средства. Cephalothin се доставя във флакони 1 и 4 g, дава се в доза 500 – 1000 mg през 4 – 6 часа, при деца – 40 – 80 mg / kg / 24 h. Препаратът представлява алтернатива за лечение на стрепто-кокови и пневмококови инфекции при алергия към пеницилини, но е по-слабо активен от тях. Cephalexin (Ceforex, Ospexin) е под формата на капсули от 250 и 500 mg, денонощната му доза е 1 – 4 g, за деца – 25 – 50 mg / kg / 24 h. Cefacetril е под формата на флакони от 1 и 4 g, дава се в доза 2 – 4 g / 24 h. При тежки инфекции дозата му може да достигне до 10 g / 24 h. Cefazolin (fl. 0,25; 0,5; 1 и 4 g) се дозира по 50 – 100 mg / kg / 24 h. С този препарат се постига 4 пъти по-висока плазмена концентрация в сравнение с цефалотина. Други препарати от тази група са Cefapirin, Cefradin, Cefazedon, Cefaclorum, Cefadroxil и др.
Към него се отнасят Cefamandol, Cefotiam, Cefoxitin, Cefotetan, Cefuroxil и др. Cefamandol (Mandokef – fl. 500 mg, 1 и 2 g) се прилага в денонощна доза 4 – 12 g. Cefuroxim (Zinnat – tab. 125, 250 и 500 mg или Zinacef – fl. 250, 750 mg и 1,5 g) се прилага с добър ефект при инфекции на меките тъкани, но също и при засягане на ставите и костите. Не бива да се смесва в една спринцовка с аминоглюкозидни антибиотици. Cefoxitin (fl. 1 и 2 g) е пеницилиназоустойчив антибиотик с добра дифузия в екстрацелуларните течности (синовиална течност, слюнка и кости). Инжектира се на 8 часа, денонощната доза достига 3 – 6 g
Те са синтезирани през 1980 г. Поради широкия си спектър и високата си активност се прилагат като животоспасяващи средства, при тежки вътреболнични инфекции, при полимикробни инфекции (каквито най-често са абсцесите и флегмоните в ЛЧО) и като алтернативно лечение при алергия към пеницилини. Повечето препарати от тази група се доставят във флакони за инжектиране. При мускулното им приложение те се разреждат с 1 ампула 2 % 2 мл. новокаин, а при венозно – с 10 – 20 мл. физиологичен или рингеров разтвор. Cefotaxime (Claforan – fl. 1 и 2 g) има висока активност срещу грам – отрицателната флора, прилага се в дневна доза 2 g, при тежки инфекции – 3 – 4 g, разделена на два приема. Cefsulodine (Monaspor – fl. 500 mg и 1 g) се прилага в дневна доза 3 – 6 g, разделена на 2 – 4 приема. Cefoperazone (fl. 1 и 2 g) е препарат със свръхширок спектър и не се разгражда от бета-лактамазите. Ефективен е срещу проблемни вътреболнични щамове, резистентни срещу други цефалоспорини. Несъвместим е in vitro с аминоглюкозиди! Прилага се мускулно или венозно в дневна доза 2 – 4 g. дневно, но при тежки случаи денонощната му доза може да достигне 16 g. Ceftriaxon (Rocephine, Longacef – fl. 250, 500 mg и 1 g) е препарат с широко приложение при инфекции в лицево – челюстната област. Характеризира се с много добра тъканна проницаемост, със забележителна поносимост и устойчивост към бета-лактамази. Прилага се за лечение на тежки инфекции, резистентни към други антибиотици – сепсис, менингити (които понякога се наблюдават като усложнение от абсцесите и флегмоните), също при инфекции при имуносупресирани болни. Дневната доза е 1 – 2 g, при тежки инфекции – 4 g. Cefixime (Ceforal, Oroken) е препарат за орално приложение. Доставя се в таблетки от 200 mg, дава се по една таблетка на 12 часа. Други цефалоспорини от трето поколение са Ceftazidine (Fortum – fl. 500 mg, 1 и 2 g.), Latamoxef (fl. 1и 2 g.), Cefotetan (fl. 1 и 2 g.), Cefotiam (Halospor – fl. 1 g.),Cefazedon (fl. 1 и 2 g.) и Ceftizoxime (fl. 500 mg. и 1 g.)
Тук спадат препаратите Cefepime (Maxiprime - fl. 1, 2 и 4 g), дава се в доза 2 – 4 g / 24 h, разделена на два приема и Cefpirome (Cefrom). Разработването на тази група цефалоспорини се наложи през последните години поради появата на множество резистентни щамове, която се получава в резултат на безразборното приложение на антибиотици в неподходящи дози, мутациите на микроорганизмите под въздействието на различни химични и радиационни фактори и т.н. Цефалоспорините от четвърто поколение имат активност към грам - отрицателните микроорганизми както на цефалоспорините от трето поколение, но са много по-активни към грам - положителните микроорганизми, особено към тези, продуциращи бета-лактамази.
Други бета - лактамни антибиотици
Съществуват и други бета – лактамни антибиотици. Поради предимствата на бета-лактамите (бактерицидно действие, минимална органна токсичност, широк спектър) непрекъснато се създават нови подгрупи:
Тук спада препаратът Imipenem (fl. 250 и 500 mg). Той се характеризира с още по-широк спектър от цефалоспорините от трето поколение, има добра поносимост. Прилага се само за спешна терапия като резервен антибиотик, понякога се комбинира с аминоглюкозиди. Дозата му е 1 – 4 g / 24 h. В препарата Tienam имипенемът е комбиниран с Cilastatin, който е инхибитор на дехидропептидаза 1 и предпазва антибиотика от инактивация в бъбреците. Друг препарат от тази група е Meropenem.
В тази група също е включен само един препарат - Aztreonam. Това е синтетичен аналог на изолиран от почвата бактериален антибиотик! Въпреки това показва много висока активност при тежки инфекции. Дозира се по 1 – 2 g. през 8 часа. Други монобактами са моксалактамът и карумонамът
Тук също е включен само един препарат – Locarbacef. Това е първият представител на тази нова група бета-лактами. Близък е по структура до цефалоспорините. Серният атом е заместен с метиленова група на първа позиция в цефемовия пръстен. Тази промяна води до засилване на химичната стабилност на цефемовата молекула. Антибиотикът се прилага двукратно дневно, има отлична ефективност при стрептококови инфекции. След орално приложение се резорбира почти напълно. Добър ефект има при стрептококов фарингит, остър отит, синузит, пневмония, остър и екзацербирал хроничен бронхит, неусложнени инфекции на долните пикочни пътищанеусложнен пиелонефрит и кожни инфекции.
Аминоглюкозидите са група антибиотици с бактерициден ефект върху микроорганизми в пролифериращо и стационарно състояние. Разцепват 30 S - субединицата на рибозомите и подтискат началната фаза и фазата на елонгация в протеиновата синтеза на микроорганизмите. Прилагат се главно при грам-отрицателни инфекциозни причинители (E. coli, Klebsiela, Proteus, Pseudomonas), много често се комбинират с бета-лактамни антибиотици. Активни са и при стафилококови инфекции. Трудно преминават хемато - енцефалната бариера, но диаплацентарно проникват добре. Екскретират се с урината, предимно чрез гломерулна филтрация. Бъбречният им клирънс кореспондира с креатиновия клирънс. С плазмените протеини се свързват слабо, имат период на плазмен полуживот около 2 часа. Като странични ефекти при аминоглюкозидите са описани ото- и нефротоксичност, ето защо не се прилагат при деца. По-рядко предизвикват алергични реакции. При бъбречна недостатъчност кумулират. При увреждане на бъбреците се явяват епителни клетки, цилиндри и лизозомни ензими в урината. Откриването на бета-2 глобулини в урината обикновено подсказва за тубулна лезия. Бъбречните увреждания са обикновено обратими, но по-голям риск съществува при болни с дехидратация, затлъстяване и хронични чернодробни заболявания. С разпространяването на тубулната некроза намалява реабсорбцията на натрий, а плазменото ниво на креатинина и аминоглюкозидите в серума се увеличава. Ототоксичните ефекти са вестибуло- и кохлеотоксични.
Групата включва редица препарати. Gentamicine се доставя в ампули 10, 40 и 80 mg – 1 и 2 ml. Дозира се по 2 – 4 mg / kg / 24 h. Dibekacine (amp. 25 mg / 1 ml. и 75 mg / 1,5 ml.) се дозира по 2 – 3 mg / kg / 24 h. Streptomycin (fl. 1 g) се използва вече по-рядко поради силната токсичност, все още се прилага като противотуберкулозен препарат. Tobramycine (amp. 20, 40 и 80 mg. 1 и 2 ml.) се дозира по 2 – 3 mg / kg / 24 h. Отличава се с по-ниска ото- и нефротоксичност от гентамицина и по-висока активност. Amikacine (fl. 100, 250, 350 и 500 mg.) се дозира по 10 – 15 mg / kg / 24 h. Sisomicine (amp. 20, 50, 75, 100 mg. 1 и 2 ml.) се прилага в доза 3 mg / kg / 24 h. Netilmicine (amp. 50, 100, 150 и 200 mg. 1 и 2 ml.) се дозира по 4 – 6 mg / kg / 24 h. Kanamycine (caps. 250 mg, tab. 125 mg, fl. 500 mg. и 1 g.) се прилага сравнително по-рядко при микроорганизми, резистентни към останалите антибиотици. Дозировката му е по 1 g.i.m. или i.v. 2 пъти дневно. Перорално дозата му е по 500 mg / 6 h, но такъв прием се прилага повече при чревни инфекции. Neomycine (tab. 50 и 200 mg.) почти не се прилага при инфекции в лицево - челюстната област, тъй като при орален прием почти не се резорбира, т.е. действа само на чревната микрофлора. При парентерален прием има особено висока ото- и нефротоксичност, поради което използването му по този начин сега е изоставено. Не бива различните аминоглюкозиди да се комбинират помежду си, тъй като се засилва тяхната нефро- и ототоксичност. Комбинирането им с фуроземид или етакринова киселина при бъбречна недостатъчност още повече увеличава токсичността на аминоглюкозидите. В областта на анестезиологията е важно взаимодействието на аминоглюкозидите с периферни миорелаксанти - удължава се периферният мускулен блок и дори е възможна парализа на дишането. Съществува синергизъм между бета-лактами и аминоглюкозиди, но и in vitro несъвместимост. Възможна е комбинацията на аминоглюкозиди с хинолони, но противомикробните им спектри се припокриват и няма потенциране.
Българският имплантологичен портал Зъбни импланти Заздравителен процес Първична стабилност
Тетрациклините са препарати с бактериостатично действие и само при венозно приложение във високи дози действието им е бактерицидно. Имат широк противомикробен спектър. Отделят се в големи количества със слюнката и поради това намират широко приложение при възпаления в устната кухина и ЛЧО. Образуват комплекси с калциевите йони и поради това се натрупват в костите и зъбите – предизвикват жълтокафяви оцветявания на зъбите и поради това не се прилагат при деца до 7 г. и бременни жени. Рядко предизвикват алергични реакции и фотодерматози. Tetracycline (caps. 250 и 500 mg, tab. 250 и 500 mg.) се прилага по 250 mg / 6 h. Максималната му дневна доза е 2 g. Не бива да се приема с мляко, с антиацидни и железни препарати поради образуването в червата на нерезорбируеми комплекси. Tetraolean (caps. 250 mg.) е комбинация от Tetracycline + Oleandomycine в дози съответно 167 mg и 83 mg. Прилага се 4 пъти по 1 – 2 капсули дневно. Oxytetracycline (caps. 250 mg.) се прилага в дневна доза 1,5 – 2 g, разделена на 3 – 4 приема. Мethacycline (Rondomycin – caps. 150 и 300 mg.) се прилага по 300 mg / 12 h. Doxycycline (Vibramycin – caps. 150 и 200 mg.) се прилага през първия ден на 2 приема по 200 mg, а след това на 2 приема по 100 mg. Излъчва се бавно от организма – до 36 часа след спиране на приема. Minocycline (tab. 50 и 100 mg.) се прилага 2 х 50 – 100 mg / 24 h. Прониква добре в тъканите, също и в ЦНС.
Макролидите са препарати също с широко приложение при абсцеси и флегмони в лицево - челюстната област. Имат бактериостатичен тип на действие, представляват добра алтернатива за лечение при алергия към бета – лактами. Поради големите си молекули и високата степен на свързване с плазмените протеини макролидите не преминават плацентарната бариера, поради което може без риск да се прилагат при бременни. Като страничен ефект са отбелязани стомашно – чревните нарушения (епигастралгия, повдигане, повръщане, диария) поради освобождаването на мотилин, мотилиноподобния ефект и промяната на чревната флора. Понякога се наблюдават алергични реакции и много рядко хепатотоксични явления. Не се комбинират с амфениколи и линкозамиди поради антагонизиране на действията им.
Erythromycine (Erythran – filmtab. 100, 200 и 500 mg.) се прилага в дози 4 – 6 х 200 mg / 24 h и е един от най-добре поносимите антибиотици. Spiramycine (Rovamycine – tab. 1,5 MUI и 3 MUI има много добър ефект при инфекции на устната кухина и ЛЧО поради отделянето чрез слюнката, а също и поради дълготрайната си фиксация в някои органи – слюнчени жлези, бял дроб и черен дроб. През първия ден се прилага в доза 12 МUI / 24 h, а след това – по 6 – 9 MUI / 24 h, разделени на 2 – 3 приема. Oleandomycine (dr. 125 mg, fl. 500 mg.) също достига висока концентрация в слюнката, прилага се в доза 1 – 2 g / 24 h на 4 приема орално или мускулно по 200 mg / 6 h. Troleandomycine се доставя в капсули и таблетки по 250 и 500 mg, дава се в доза 250 – 500 mg / 6 h. Създава в кръвта повече от два пъти по-висока концентрация в сравнение с олеандомицина. Clarithromycine (Klacid – tab. 250 mg.) е синтетично производно на еритромицна с два пъти по-висока антимикробна ефективност. Прилага се по 250 mg. два пъти дневно, при по-тежки инфекции – по 500 mg. Josamycine (Josacin, Wilprafen – filmtab. 500 mg, sirupus 30 или 60 mg / ml.) е сравнително нов препарат от тази група, отличаващ се с повишена активност спрямо резистентните на еритромицин щамове на Staph. aureus. Дава се в доза 2 х 0,5 – 1 g / 24 h. Mydecamycine (Macropen – tab. 400 mg) e също нов препарат с много добра дифузия в тъканните течности и нисък процент на свързване с плазмените протеини (около 10 %), поради което препаратът се прилага с добра ефективност при септични състояния. При възрастни дозата е по 1 табл. 3 или 4 пъти дневно, а при деца – 20 – 50 mg / kg. телесна маса. Отличава се също и с много добра поносимост. Roxithromycin (Rulid – tab. 150 mg.) се дава в доза по 1 табл. на 12 часа. Свързва се във висок процент с плазмените протеини – до 96 %. Прониква добре в тъканите и поради това намира също широко приложение при абсцеси и флегмони.
Амфениколите са препарати с бактериостатичен тип на действие, резорбират се бързо и пълно, достигат високи терапевтични концентрации в телесните течности и вътрешните органи. Chloramphenicol (Chlornytromycin, Laevomycetin) се доставя в таблетки и капсули по 250 mg. и в ампули 1 g. Има широк спектър, лесно се резорбира, но има кратък плазмен полуживот. Дава се на 4 приема по 500 mg. per os или 2 x 1 g / 24 h i.m. В днешно време се прилага само при абсолютна необходимост при инфекции, неподдаващи се на други антибиотици. В областта на лицево – челюстната хирургия се прилага най-вече при септични състояния с причинител пиогенни стрептококи, пневмококи, анаеробни стрептококи и клостридии. Не се прилага заедно с кумаринови антикоагуланти, фенитоин и алкохол, тъй като е ензимен инхибитор и подтиска разграждането им. Тежък страничен ефект е медуларната аплазия с апластична анемия, ето защо не се прилага при бременност и новородени. Thiamphenicol (tab. 250 mg.) се прилага в денонощна доза 1,5 – 3 g, разделена на 4 приема. Има сходни характеристики и странични ефекти с хлорамфеникола, затова също се прилага само при абсолютна необходимост.
Линкозамидите са препарати, достигащи сравнително висока концентрация в костната тъкан и същевременно ефективни при възпаления в меките тъкани, поради което намират приложение в медикаментозната терапия на абсцесите и флегмоните в ЛЧО. Засилват действието на наркотичните аналгетици. При комбинация с общи анестетици, аминоглюкозиди или нервно – мускулни блокери могат да предизвикат дихателни нарушения. Lyncomycin (Cillimycin – caps. 250 и 500 mg, amp. 600 mg / 2 ml. и 1 g / 10 ml.) се дава в доза 3 – 4 табл. по 500 mg / 24 h. Clindamycin (Dallacin C – caps. 75, 150 и 300 mg, amp. 200, 400, 600 и 900 mg. 2, 4 и 6 ml.) се дава в доза 600 – 1800 mg / 24 h, разделена на 3 или 4 приема.
Синергистини
Синергистини са два препарата: Virginiamycine (tab. 250 mg.) и Pristinamycine (tab. 500 mg.). Тази група е родствена на макролидите, показва висока ефективност при инфекции на устната кухина, но при липса на менингеални усложнения. Virginiamycine се дава по 2 – 3 g / 24 h, разделени на 4 – 6 приема, а Pristinamycine – в същата доза, но на 2 приема. При тежки инфекции дневната доза на препаратите може да се повиши до 4 g.
Рифампицините се използват предимно като противотуберкулозни средства, но намират приложение и при стафилококови, менингококови и някои грам – отрицателни инфекции. Rifampicine (Rimactan, Tubocin – caps. и dr. 150 и 300 mg, amp. 300 mg) се дозира по 450 – 600 mg / 24 h. Rifamycine (Tuborin – amp. 125 mg / 2 ml. и 250 mg / 4 ml.) се дозира по 500 – 750 / 24 h за мускулен и 0,5 – 1,5 g / 24 h за венозен прием. И двата препарат често се комбинират с други антибиотици, но не и с цефалоспорини поради възможния антагонизъм.
Полимиксините са антибиотични препарати с полипептридна стуктура и бактерициден тип на действие. Polymixine B се доставя във fl. 50 mg / 5 ml. Абсорбира се много слабо от лигавиците и не прониква през здравата кожа, ето защо се прилага само парентерално в доза 1,5 – 2,5 mg / kg / 24 h, раделена на 3 или 4 инжекции. Colistine се доставя във fl. 0,5 и 1 MUI и се дозира по 50 000 UI / kg / 24 h, разделени на 2 или 3 приема. Двата препарата имат потенциално нефро- и невротоксично действие, предизвикват и алергични реакции. Доставят се и в таблетки за орална употреба, но последните се прилагат само при стомашно – чревни инфекции.
Други антибиотици
Съществуват и други антибиотици - различни препарати, намиращи все по-широко приложение в борбата срещу инфекциите. Novobiocin (caps. 250 mg.) е препарат с бактериостатично действие и дозировка 1 – 2 g дневно на 4 приема. Прилага се при повърхностни и дълбоки инфекции на меките тъкани и сепсис. Vancomycine (caps. 250 mg, fl. 125, 250, 500 mg. и 1 g.) е антибиотик с глюкопептидна структура и бактериостатичен тип на действие. Дозира се по 1 – 2 g / 24 h, практически не се резорбира, поради което се прилага изключително венозно. Teicoplanine (fl. 200 и 400 mg.) е също с глюкопептидна структура, има бактерициден тип на действие. Внася се венозно на един прием – през първия ден 400 mg, след това – по 200 mg. Fosfomycine (amp. 2, 3 и 5 g.) е антибиотик, който няма никакво структурно сходство с останалите групи и поради това не показва кръстосана резистентност с тях. Често обаче бактериите развиват резистентност към него от мутационен тип, поради което се комбинира с бета-лактам или аминоглюкозид. Дозира се по 6 – 15 g / 24 h, разделени на 2 – 3 венозни приема. Acidum fusidinicum (tab. 250 mg, fl. 500 mg.) е антибиотик със стероидна структура и приложение главно при стафилококови инфекции. Дозира се по 1,0 – 1,5 g / 24 h, разделени на два или три приема. Поради възможността за развитие на резистентност от мутационен тип е добре да се комбинира с бета-лактами или макролиди.
Сулфонамидите са няколко групи – леснорезорбиращи се с краткотрайно и средно действие, депо – сулфонамиди и труднорезорбиращи се сулфонамиди. Прилагат се и комбинирани сулфонамидни препарати. Сулфонамидите имат структурно сходство с ПАБК и подтискат синтеза на фолиевата киселина от микроорганизмите. Не се комбинират с прокаин и анестетици, производни на ПАБК! Sulfathiazol (Norsulfazol – tab. 500 mg, pulv.) e препарат с бактериостатично действие. Дозира се по 2 табл. на 4 – 6 часа. Sulfacetamid (tab. 500 mg.) и Sulfacarbamide (tab. 500 mg.) се дозират по същия начин. И трите препарата са от групата на леснорезорбиращите се сулфонамиди с краткотрайно действие. Със средно действие са препаратите Sulfametoxazole ( 500 mg, дава се 2 х 2 – 3 табл.) и Sulfadiazine (tab. 500 mg, дава се по 2 табл. на 4 или 6 часа). Депо – сулфонамиди са Sulfadimetoxin (tab. 500 mg, дава се в начална доза 2 табл. дневно, впоследствие – 1 табл. дневно) и Sulfamethopyrazin (tab. 200 mg, дава се еднократно – през първия ден 800 mg, впоследствие – по 200 mg.). Тези препарати се резорбират и излъчват бавно, ето защо имат пролонгирано действие. Труднорезорбиращи се сулфонамиди са Sulfaguanidine и Phtalylsulfatiazole. Те намират приложение най-вече при стомашно – чревни инфекции.
При комбинация на сулфонамидите с триметоприм се получава супраадитивно взаимодействие – блокира се синтезата на фолиевата киселина на два етапа и се усилва ефектът на препаратите. Препаратът Co-trimoxazole (Biseptol, Bactrim) съдържа Sulfamethoxazole + Trimetoprim. Poteseptil съдържа Sulfadimezinum + Trimetoprim, а Lidaprim – Sulfametrol + Trimetoprim. И при трите препарата сулфонамидът е 400 mg, a триметопримът – 80 mg. Дават се 2 х 2 табл. дневно. Приложението на сулфонамидите при тежки инфекции трябва да става много внимателно, тъй като те се явяват антитироидни препарати и подтискат оздравителния процес.
Хинолоните са противомикробни препарати, въведени през 1963 г. Инхибират ДНК-топоизомераза 2 (гираза). Този ензим участва в свръхспирализацията на микробната ДНК – при приложение на хинолони се нарушава третичната структура на молекулите, а по този начин и способността на бактериите за деление. Класическите хинолони са Ac. nelidixicum, Ac. oxolinicum, Ac. pipemicicum и Cinoxacine. В днешно време те намират приложение почти само при инфекции на пикочо – половата система. Истински успех в антибактериалната терапия представлява въвеждането на 4-флуорхинолоните. Тяхната ефективност сега е 85 – 96 % и се доближава до тази на трето поколение цефалоспорини. Ciprofloxacine (tab. 250, 500 и 750 mg, fl. 200 mg.) има дълъг полуживот в плазмата и поради това се прилага през 12 часа по 2 таблетки. Максимално се прилагат 2 х 750 mg. дневно. Препаратът има много широк спектър на действие. Pefloxacine (tab. и amp. 400 mg.) се прилага също 2 пъти дневно, дава се по една таблетка. Ofloxacine (filmtab. 200 mg.) се дава в доза 2 х 1 табл. / 24 часа. Enoxacine (Gyramid – filmtab. 200 и 400 mg.) се дава по 200 – 400 mg / 12 h. Има най-силно проникване в тъканите от всички хинолони. Norfloxacine (tab. 400 mg.) се дава по една таблетка 2 пъти дневно. Rosoxacine (caps. 150 mg.) се дава по 300 mg / 24 h еднократно. Fleroxacine (tab. 200 и 400 mg.) се дава в доза 400 – 800 mg / 24 h на два приема.
Антипротозойните средства също намират приложение при медикаментозното лечение на абсцесите и флегмоните, тъй като показват и висока активност срещу анаеробната флора. Metronidazole (filmtab. 250 и 500 mg.) се дава в доза 500 – 1000 mg / 24 h, разделена на 2 приема. Ornidazole (tab. 125 и 500 mg.) се дозира по същия начин. Tinidazole (tab. 150 и 500 mg.) се дава в начална доза 2 g еднократно през първия ден, след това – по 1 g дневно. Secnidazole (Flagenyl – tab. 500 mg.) се дозира по същия начин.
Принципи на приложение на антибиотичната терапия
Лечението с антибактериални средства при абсцесите и флегмоните се провежда в срокове от 6 до 12 дни в зависимост от протичането на възпалителния процес. Обикновено то се спира след нормализирането на телесната температура и на базата на показателите от периферната кръв. Възникването на усложнения е предпоставка за смяна на препарата. Няколко пъти седмично трябва да се прави анализ на резултатите от периферната кръв и урина, както и посявка от раневата секреция. При използване на препарати с широк спектър се назначават и антимикотични средства. При липса на ефект от лечението причините са от различен тип: инфекцията може да не е от бактериален тип, да е допусната грешка в дозировката на антибиотика, която води до резистентност, да има условия за суперинфекция, да е подтисната имунната система или да не е осигурен адекватен дренаж за ексудата.
Copyright©by everybody
В заключение следва да споменем някои негативни ефекти от антибиотичната терапия. Извън техните странични ефекти от страна на храносмилателната, отделителната, нервната и други системи при употребата на антибиотици се наблюдава един тревожен ефект, който засяга всички хора в световен мащаб - култивирането на резистентни щамове. През 2020 година сред населението на целия свят доминираха страховете от COVID-19, но на фона на всеобщата паника остана незабелязан един съществен проблем - антибиотичната резистентност. Така например според различни научни публикации около 20 % от американските граждани, хоспитализирани поради инфекция от коронавирус, развиват резистентност към някой от използваните в момента антибиотици. Това се получва поради назначаването на немалки антибиотични дози чисто профилактично - за да се застрахова терапевтът от бактериална суперинфекция, макар че пак според научните данни до момента причина за смъртта на болните с коронавирус не е наслагването на бактериални инфекции, а дихателната недостатъчност и различните полиорганни дисфункции.
Според различни прогнози на фармацевтичния сектор през 2030 година много повече хора ще умират в резултат на антибиотична резистентност, отколкото например от теористични актове. През 2050 година антибиотичната резистентност ще бъде най-честата причина за смърт в световен мащаб - предполага се че до тогава многократно ще намалят смъртните случаи от сърдечно - съдови и онкологични заболявания, които към момента са съответно причина номер 1 и 2 като честота за смърт в човешката популация. Необоснованото приложение на всякакви антимикробни препарати във високи дози води до развитие на тотална резистентност към тях; важна е и продължителността на приложение на терапията, като резистентни щамове се култивират и при прекалено кратки, и при прекалено дълги антибиотични курсове. Краткият антибиотичен курс не унищожава напълно микроорганизмите, част от тях преживяват и синтезират ензимни молекули, способни да разграждат антибиотика. Обратно, дългият антибиотичен курс кара унищожава всички микроорганизми, които са причинител на съответното възпаление, но същевременно предизивиква синтез на същите ензимни системи у микроорганизми, които към момента не предизвикват патологични процеси в организма - например Escherichia coli. Въпросните микроорганизми продължават да съществуват, но вече имат механизми за противодействие на молекулата на антибиотика. При определени условия тези микроорганизми стават патогенни и в комбинацията с антибиотичната си устойчивост могат да предизвикат един наистина тежък възпалителен процес - например сепсисът с причинител Escherichia coli е с много висок леталитет. Поради това, както стана вече въпрос, оптималната продължителност на един антибиотичен курс е от порядъка на 6 - 12 дни, рядко повече и никога по-малко.
През 2020 година около 700 000 души в световен мащаб умират поради антибиотична резистентност. Прогнозите на СЗО са през 2050 година тази бройка да достигне 10 милиона души годишно. Пак през същата година изследователите разработваха около 550 иновативни лечения против COVID-19 - патоген, който само една година преди това, през есента на 2019 година, беше на практика непознат. Въпреки че проблемът с антибиотичната резистентност е познат от няколко десетилетия, от 1984 до 2020 година в клиничната практика е въведен само един нов клас антибиотици. Получава се парадоксалната ситуация човечеството тихо да умира от антибиотична резистентност, докато изпада в ужас от коронавируса. Нещо подобно е налице и при туморите и сърдечно - съдовите заболявания - вторите са много по-честа причина за смъртността от неоплазиите, но хората изпадат в ужас от злокачествените тумори и в резултат на това умират от инфаркти и инсулти. Според различни статистики само 7 % от случаите с коронавирус са имали реална нужда от антибиотична терапия, тъй като са развили съпътстваща бактериална инфекция. Известно е че антибиотиците не повлияват вирусите по никакъв начин, което прави приложението им при вирусни инфекции вредно и неоправдано; според доц. Иван Иванов, ръководител на Националната рефернетна лаборатория 75 % от заразените с коронавирус български граждани са приемали антибиотик. Според различни клинични проучвания, някои от които - върху десетки хиляди случаи, само около 7 % от всички болни с коронавирус развиват придружаваща бактериална инфекция. Това показва една тревожна тенденция, която се наблюдава в пандемичната обстановка. Излишната употреба на антибиотици създава резистентни към тях бактерии, които след време причиняват тежки, а понякога и фатални инфекции. Огромният ръст в предписването им за периода 2020 - 2021 година се дължи на комбинация от паника, лошо управление на здравната система, нисък контрол върху аптеките и лекарска безотговорност.
При наличие на инфекция от коронавирус се изисква поне антибиограма, за да се установи има ли изобщо насложена бактериална инфекция. Желателно е при сигурно диагностицирана бактериална инфекция също да се изготвят антибиограми - за да се установи срещу кои антибиотици е най-чувствителен микробният причинител и съответно да се приложат именно те в терапията на болния. През 2020 година НЗОК е заплатила 106 000 антибиограми при продадени 12 милиона опаковки антибиотик. Същата тенденция се запазва и през 2021 година - до месец ноември са заплатени 103 974 антибиограми. Както сполучливо се изразяват журналисти от различни икономически издания, става въпрос за една антибиотична вакханалия и очевидно в сърцата на големите фармацевтични компании има запазено специално място за България - тя е една от държавите, в които има стабилен ръст в употребата на антибиотици. За период 2011 - 2021 година този ръст е средно от 2.4 % годишно. Употребата на антибиотици на глава от населението в България е 3.8 пъти повече отколкото в Германия и 2.3 - 2.5 пъти отколкото в Словакия, Словения и Унгария. По време на пандемията се наблюдава още по-голям ръст - за периода октомври 2020 - октомври 2021 година са продадени антибиотици на стойност 184 милиона лева, или с ръст от цели 43 % спрямо аналогичния период - октомври 2019 - октомври 2020 година. Около 80 % от тези медикаменти са продадени през аптеките, където ръстът е 36 %. В болниците се наблюдава умопомрачителен ръст - 77 %!
Ефектите от това са зловещи. Пациенти с инфаркти, инсулти и тежки травми започват да умират много по-често не от основното заболяване, а от вътреболнична инфекция, която е предизвикана от микроорганизми, резистентни на антибиотици. Спорез различни статистически данни около 69 000 човека годишно в България развиват вътреболнични инфекции, а около 2000 от тях губят живота си. Разбира се, много често развитието на вътреболнични инфекции и методите са тяхната превенция са тема табу - по понятни причини, тъй като диагнозата вътреболнична инфекция може бързо да доведе до съдебни дела и осъдителни присъди към лечебното заведение. По тази причина ръководствата на болниците нямат интерес да ги съобщават, докато в много други страни има обратната тенденция - болниците се стимулират да регистрират вътреболнични инфекции. В много случаи при често развитие на подобни инфекции се правят основни строителни ремонти на отделенията и дори се разрушават цели болници и се построяват отново - твърде крайна мярка според нас, но при старо оборудване и засечени подови настилки и стенни покрития е очевидно че вътреболничните инфекции ще бъдат по-чести.
На практика по неофициални данни всеки втори пациент, лежал в болница, получава антибиотична терапия - с или без индикации. Това култивира така наречените супербактерии - особени резистентни към антибиотиците микроорганизми, които предизвикват вътреболнични инфекции. Такива микроорганизми не се срещат или се срещат изключително рядко в околната среда извън болниците; заразяването с тях в болница изисква все по-тежка и по-комплексна антибиотична терапия. В извънболничната медицинска помощ пък различни проучвания посочват че от 50 до 80 % от антибиотиците се изписват без реално да са небходими. Протоколите за лечение на коронавирус силно повишиха употребата на азитромицин и левофлоксацин - съответно с ръст от 68 % и 100 %.
В България липсва надеждна статистика за разпространението на мултирезистентни бактерии и на антибиотичната резистентност като цяло. Има обаче обширни социологически проучвания - според доц. Михаил Околийски 60 % от българите смятат че антибиотиците са активни срещу вируси, простудни заболявания и грип, а 40 % от населението се самолекува с антибиотици. Ако към тази мрачна статистика се прибави и нулевата заинтересованост към употребата на антибиотици в животновъдството, положението става критично - логично в организма на домашни и селскостопански животни също има микроорганизми, които биха могли да развият резистентност и да станат патогенни и за човешкия организъм.
В повечето страни по света употребата на антибиотик започва задължително след преглед от лекар, назначено микробиологично изследване и антибиограма, и разбира се, след изписана рецепта. В някои случаи има изключения - по спешност може да се започне емпирична терапия и след излизане на антибиограмата терапията да се коригира. Повечето пациенти обаче предпочитат да не извървят целия път до лекарството с рецепта и директно си закупуват антибиотика от аптеката - защото са го използвали, чули са от приятели и роднини че действа при тяхното заболяване или са прочели за това в Интернет. Антибиограмите в извънболничната мединска помощ за лукс, като цяло антибиотици се изписват на око и често по изричното настояване на пациента (за всеки случай). Много хора често сменят личния си лекар в случай че не им се изписват антибиотици - това се счита за некомпетентност и за безотговорност към здравето на пациента от страна на висшия медицински персонал. Има фрапиращи случаи - идват болни, които са пили един, втори антибиотик, по тяхна преценка терапията не е ефективна и сега вече са решили да посетят лекар, за да изискат още едно мнение. Употребата на антибиотици в България в огромната си част представлява самолечение. Към момента може да си закупи антибиотик от аптеката без рецепта в огромна част от случаите. Ако се прибере рецептата на болния закупуване на антибиотика би могло да има по-ясна представа за потреблението - разбира се, електронната рецепта е много по-добър вариант за това. При домашни посещения и изваждане на рецептите пациентите обикновено много често казват да почакаме и отварят поне един шкаф, който може да конкурира която и да е аптека - пълен с лекарства от времето, когато Станко Тодоров е бил председател на Народното Събрание. Пациентът е пил едно лекарство два дни, после друго за три или чеитири дни, и всичко се прибира в шкафа на принципа че може да потрябва. При посещения при деца се откриват отворени опаковки, които стоят с месеци в хладилника и след това се разменят с други майки.
Съществуват и много побългарени схеми на терапия. Описан е случай на пациент, който отива при общопрактикуващ лекар и казва че иска да се консултира за това, че пил четири дни по една таблетка от определен антибиотик - разбира се, в неправилна доза. Антибиотикът е останал от сина му и за да не го изхвърля, го е пил - подобно на храната, останала след коледната трапеза, която някой изяжда, за да не се изхвърля. Има пациенти, които пият по два или дори по три антибиотика - почти винаги тотално несъвместими. Съществуват майки, прочели около 10 000 постинга в bg-mamma, които често сменят личния си лекар със следния аргумент: "Искам да дойда, да ме прегледате и да ми дадете един антибиотик и готово! Никак не съм доволна от предишния личен лекар!"
Всичко това може да се промени доста бързо с въвеждането на електронна рецепта. Тогава лесно може да се проследи кои аптеки продават антибиотици без рецепта и при необходимост могат да се налагат финансови санкции. Също може да се проследява и кои общопрактикуващи лекари и специалисти изписват необосновани антибиотични терапии, които биха могли да доведат до развитието на резистентни щамове. По този начин е установено че през 2012 година в Южна Корея около 80 % от всички налични в околната среда микроорганизми са резистентни на действието на антибиотика Clindamycin - поради честото му постоперативни приложение в областта на имплантологията. След взетите адекватни мерки от страна на регулатора безогледната употреба на този антибиотик е прекратена и през 2019 година общата резистентност срещу него спада на 30 %.
По време на пандемията се оформи своеобразен омагьосан кръг с масовото предписване на антибиотици. Принципно нито един антибиотик няма как да повлия върху коронавируса, освен в крайната фаза, когато са засегнати белите дробове и има насложена бактериална инфекция. Лекарите обаче искат да се презастраховат в случай че пациентът се влоши; фармацевтичните компании ги стимулират по един или друг начин да изписват още и още антибиотици. Същевременно самият пациент настоява веднага и без отлагане да му се изпише антибиотик, при което крайният резултат е известен. Освен това пациентите не спазват точния час за прием, при наличие на бактериална инфекция започват да се чувстват по-добре на третия или четвъртия ден и вземат самостоятелно решение да спрат терапията. Оптималните срокове за прием на антибиотик са от пет до седем дни - и по-ранното, и по-късното преустановяване на приема води до развитие на още и още резистенти щамове. При по-ранно спиране остава известно количество микроорганизми, което синстезира ензими, които разграждат антибиотичната молекула; същото се случва и при по-продължителна терапия, но в този случай ензимите се синтезират от други микроорганизми, които се намират при нормални условия в организма и не са патогенни. В крайна сметка след време винаги се стига до ситуация, при която дори една банална инфекция няма да има с какво да се лекува.
Изключително успешната фармацевтична индустрия, която през последните 40
години на практика успя да ликвидира някои заболявания, се оказва безпомощна
срещу антибиотичната резистентност по чисто икономически съображения.
Фирмите, които разработват авангардни нови антибиотици, са изправени пред големи
предизвикателства. Справянето с регулаторното одобрение и потенциалните проблеми
с безопасността е скъпо и отнема много време; изисква и умения и контакти на
различно правителствено ниво, които липсват при по-малките производители на
лекарства. Евентуалните продажби представляват още по-голям проблем - новите
антибиотици трябва да с еизползват изключително пестеливо, за да се предотврати
развитието на устойчивост към тях при микроорганизмите. В идеалния случай те
трябва да представляват стратегически резерв срещу бактерии, устойчиви срещу
повечето антибиотични препарати. Следователно евентуалните продажби ще бъдат
много ниски - болниците ще имат само няколко дози, всичко под ключ, само з
аспешна употреба. Това означава че потенциалната възвръщаемост ще бъде твърде
ниска, за да оправдае разходите на производителя за развойна и
научноизследователска дейност. Допълнителен немалък проблем представляват и
високите чисто лицензионни разходи, които са свързани с узаконяването на нов
антибиотик - в САЩ всеки, който желае медикаментът му да бъде одобрен от местния
регулаторен орган FDA (Foods and Drugs Administration) трябва да
приготви около един милиард долара и да изчака средно пет години.
В основата на тази обърната надолу с главата икономика стои въпросът как
да се определи стойността на лечението, което може да се използва рядко. Джон Рекс, главният икономически директор на британската биотехнологична фирма
F2G Ltd, сравнява новите антибиотици с пожарогасителите - абсолютно жизненоважни, но в реалния случай рядко необходими. Шест компании все още усърдно провеждат проучвания в тази насока въпреки малките
шансове за успех - Merck, GlaxoSmithKline, Shionogi и Roche. Pfizer през 2019 година
придобива Arixa Pharmaceuticals - малка компания, базирана в Калифорния, която разработва иновативни медикаменти против
микроорганизми, резистентни на антибиотици. Но много производители на лекарства
са изоставили изследванията за антибиотици - големи фирми като Novartis,
Astra Zeneca и Sanofi напуснаха пазара отдавна, а за периода 2016 - 2020 са фалирали четири по-малки компании,
фокусирани върху антибиотиците. Глобалната здравна общност за щастие отдавна е
осъзнала спешната нужда от нови антибиотици, но въпреки това до момента има
много приказки и малко действия. Не е изненадващо че политическите лидери много
по-лесно дават декларативни изявления по време на срещи на високо равнище, отколкото да
подписват чекове за милиарди долари, за да оправят проблемния пазар. Всъщност
пазарът в случая не е проблем, а решение - необходимо е просто да се намали
регулаторната тежест като начало и да се проследи ефектът от промените.
През месец юли 2020 година стартира фонд AMR. Той е
подпомогнат от най-големите производители и ще инвестира около 1 милиард щатски
долара в по-малки биотехнологични фирми с цел да се осигурят поне 2 - 4 нови
антибиотика на пациентите до 2030 година. Идеята на тази инвестиция е да се
преодолее така наречената долина на смъртта между лабораторните изследвания и
клиничните изпитвания. Инициативата да се основе подобен фонд е възникнала през
2019 година и е широко приветствана от политиците общественото здравеопазване,
включително и от генералния директор на СЗО по това време - Тедрос Адханом
Гебреесус. Докато чакаме тези благородни инициативи да дадат поне някакъв
минимален резултат, е добра идея лекарите поне малко да ограничат прекомерната
употреба на антибиотици; отделно много пациенти сами си назначават терапии
и това утежнява ситуацията. Повечето аптеки отказват да продават антибиотици без рецепта, но далеч не всички са толкова добросъвестни
и това влошава ситуацията. Налице е и индустриална
употреба на антибиотици - в различни пречистващи продукти и при
селскостопанските животни с цел по-бързо наддаване на тегло. Ефектът от подобни
методи е създаване на резистентни щамове, от което страда цялото общество.
Но в крайна сметка трябва забавянето на
разпространението не е достатъчно. Трябва фундаментално да променим начина, по
който оценяваме новите антибиотици. Вместо да се свързва цената им с
използваното количество, би трябвало те да се разглеждат като застрахователна полица за
медицина и здравни услуги. Независимият преглед на Обединеното Кралство за антимикробна резистентност от 2014 до 2016 година с председател
икономиста Джим О'Нийл е изчислил следното: за преодоляване на най-лошия
сценарий от 10 милиона смъртни случая през 2050 година е необходима инвестиция
от поне 42 милиарда долара в рамките на следващото десетилетие. Потенциалните
икономически щети обаче като резултат от антибиотичната резистентност за периода
2015 - 2050 година са в рамките на 100 трилиона долара, т.е. инвестицията е
оправдана и разумна. Американският сенат обмисля възможно законодателно средство
за защита - да се създадат стимули, които да възнаграждават биотехнологичните
компании да разработват иновативни антибиотици. От икономическа гледна точка
подобна практика би могла да доведе до едно безсмислено харчене на държавни
средства, тъй като е доказано че всяко физическо лице или компания работят много
по-ефективно, когато им се заплаща на извършена дейност, а не според работното
време; а на компаниите ще се плаща на абонаментен принцип независимо каква част
от новосинтезираните молекули се прилага на практика. Така или иначе обаче,
светът се намира в състояние на оръжейна надпревара с микробите. Засега
микроорганизмите печелят. Но с решаването на дългогодишни проблеми на пазара на
антибиотици бихме могли да обърнем хода.
Много често се прилагат антибиотични
курсове постоперативно например след екстракцията на
ретинирани мъдреци без
наличие на локален възпалителен процес (при чисто оперативно поле). Няма
обективна причина за назначаване на постоперативен антибиотик в такива случаи -
особено когато мъдрецът е екстрахиран бързо и атравматично. Налице е
следоперативен оток, но той се причинява от кръвонасядане (хематом), а не от
възникнала инфекция. Единствено като профилактика на инфектирането на хематома
може да се назначи антибиотик, но при наличие на антибиотик отокът отзвучава за
седем дни, а при липсата му - за една седмица.
Бета - лактамни антибиотици
Пеницилини
Пеницилиназа - неустойчиви тясноспектърни пеницилини
Пеницилиназа - устойчиви тясноспектърни полусинтетични пеницилини
Група на метицилина
Изоксазолилпеницилини
Аминопеницилини
Карбоксипеницилини
Уреидопеницилини
Амидинопеницилини
Протектирани пеницилини
Цефалоспорини
Първо поколение цефалоспорини
Второ поколение цефалоспорини
Трето поколение цефалоспорини
Четвърто поколение цефалоспорини
Други бета - лактамни антибиотици
Карбапенеми
Монобактами
Карбацефеми
Аминоглюкозиди
Тетрациклини
Макролиди
Амфениколи
Линкозамиди
Синергистини
Рифампицини
Полимиксини
Други антибиотици
Сулфонамиди
Хинолони
Антипротозойни средства
Принципи на приложение на антибиотичната терапия