Човешкият организъм притежава няколко неспецифични защитни системи, които се активират при откриване на генетично чужди тъкани, клетки или дори и само молекули където и да е в тялото. Тези системи са тясно интегрирани към имунната система на организма и представляват една допълнителна защита по отношение на потенциални и реални инфекциозни агенти. Въпреки че сайтът www.maxillofacial-bg.com с насоченост основно към лицево - челюстната хирургия, тези системи ще бъдат подробно разгледани и описани, тъй като познаването на имунните механизми е от ключово значение за всеки практикуващ хирург с оглед честото развитие на възпалителни процеси в лицево - челюстната област и необходимостта от тяхното адекватно лечение.
В изграждането на кининовата система участват брадикинин и каликреин, които са нискомолекулни пептиди. Брадикининът е най-добре изследван и характеризиран. Той има изразен хипотензивен ефект и силно повишава съдовата проницаемост. Обуславя чувството за болка в огнището на възпалението. Каликреинът участва в хемотаксичната активност на неутрофилните левкоцити и притежава способност за реципрочна активация на фактора на Хагеман (фактор 12 на кървосъсирващата система). Кининовата активация се регулира от карбоксипептидазата (киназа 1), а киназа 2 бързо инактивира фактора.

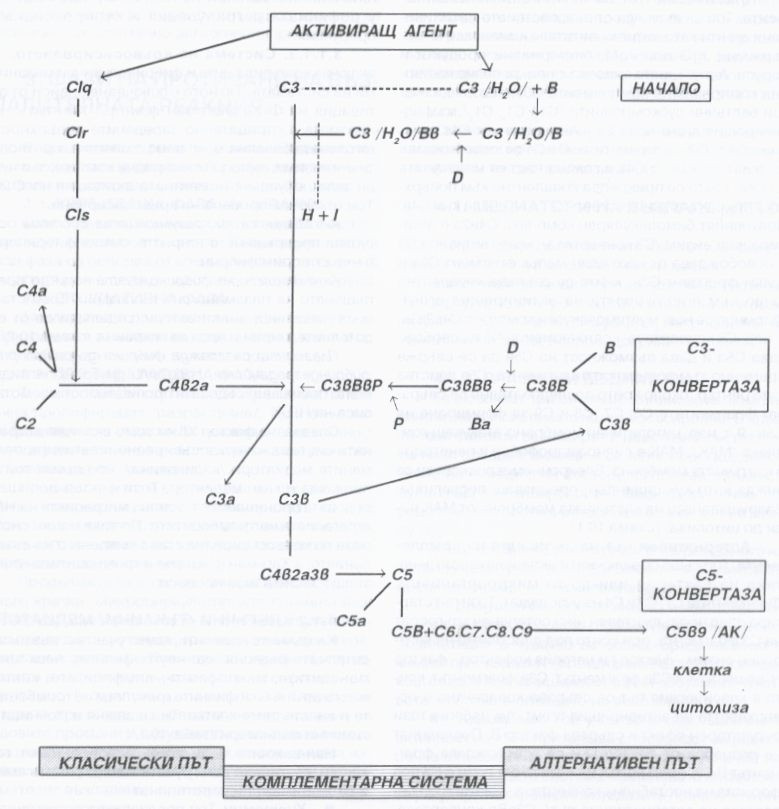
Схема на двата пътя на активиране на комплемента - класически и алтернативен. Комплементарната система е група от 20 плазмени протеини, които играят важна роля в защитата на организма срещу бактериални инфекции и като медиатор във възпалителния отговор. Системата може да се активира от два независими от друг пътя - класически и алтернативен. Активацията на комплемента по всеки един от тези два пътя води до образуване на ензими, които активират третия или петия компонент от системата - С3 или С5. Този процес генерира комплекс, който атакува клетъчната мембрана и причинява лизиране на клетките - именно по такъв механизъм системата на комплемента разрушава всички клетки (а съответно и тъкани), които се разпознават като чужди за организма и съответно биха представлявали потенциална опасност. По време на активацията се освобождават много от биологично активните субферменти на системата - С3а, С4а, С5а.
Класическият път на активацията на комплемента се включва под въздейтвие на антиген - антитяло комплексите, съдържащи IgM или IgG, бактериални продукти и вируси. Активацията започва с прикрепването на първия компонент на комплемента - С1, който пептид се състои от три по-малки молекули - C1q, C1r и C1s. Прикрепването се осъществява към фракцията C1q. Молекулата C1s активира компонентите С2 и С4. От С4 се освобождава малкият фрагмент С4а и голяма част от молекулата на С4в, която се прикрепва ковалентно към повърхността на активиращия агент. С2 се захваща към С4в. Полученият бимолекулярен комплекс С4в2а е активиращият ензим С3 - конвертаза, който активира С3 и освобождава от един малък фрагмент С3а и по-голям С3в, който също се свързва ковалентно към повърхността на антивиращия агент. Формира се нов, мултимолекулен комплекс С4в2а3в. Това е така наречената С5 - конвертаза, която активира С5, освобождава С5а и дава възможност С5в да се свърже временно към повръхността на агента. С5в действа като център, около който последователно се свързват агентите С6, С7, С8 и С9. Така се формира цитолитично мембранно - атакуващ комплекс (МАК). Той е силно хидрофобен и пенетрира в клетъчната мембрана, която е изградена основно от фосфолипиди и поради това е също хидрофобна. Електронномикроскопски комплексът от факторите на комплемента се вижда като кух цилиндър, който преминава през мембраната. Разрушаването на клетъчната мембрана води до цитолиза - това е основната функция на системата на комплемента и именно по този начин се разрушават клетки, които са чужди за организма и са потенциален причинител на заболявания.
Алтернативният път за активация на комплемента също се активира от бактерии и други микроорганизми. Фрагментите С1, С2 и С4 не участват в този път. Той стартира след продължителен нискостепенен кръговрат на С3 - фрагмента, при който под действието на контролен ензим (фактор 1 и неговият кофактор Н) се образува С3в - фрагментът. При класическия път този фрагмент се свързва ковалентно с повърхността на активиращия агент, но тук тук факторът избягва този регулаторен ефект и се свързва с фактор В. Последният се разцепва от фактор Д и се освобождава фрагментът Ва, докато фрагментът Вв остава свързан с С3 под формата на нестабилна конвертаза - С3вВв, наречена още С3 - конвертаза на алтернативния път. Тя се стабилизира от един протеин - пропердин, в комплекс С3вВвР, наречен пропердин - стабилизирана конвертаза на алтернативния път. Този комплекс активира С3 и С5 за формиране на МАК по идентичен на класическия път механизъм.
Пептидите С3а, С4а и С5а се наричат анафилатоксини (ААФ). Те причиняват гладкомускулна контракция и увеличават съдовата проницаемост. Последният ефект отчасти е моделиран от секрецията на хистамин в момента на взаимодействие на ААФ с мастоцитите и базофилните клетки. С5а е с най-силна, а С4а е с най-слаба анафилатоксична активност. С5а е най-мощният хемотаксичен фактор за неутрофилните левкоцити, еозинофилите, базофилите и моноцитите. Той стимулира също неутрофилната дегранулация и супероксидната продукция.
Системата на кръвосъсирването няма пряко отношение към разрушаването на потенциални и реални инфекциозни агенти, но в същото време е доста тясно интегрирана към имунната система, поради което също ще бъде разгледана в тази секция на нашия сайт.
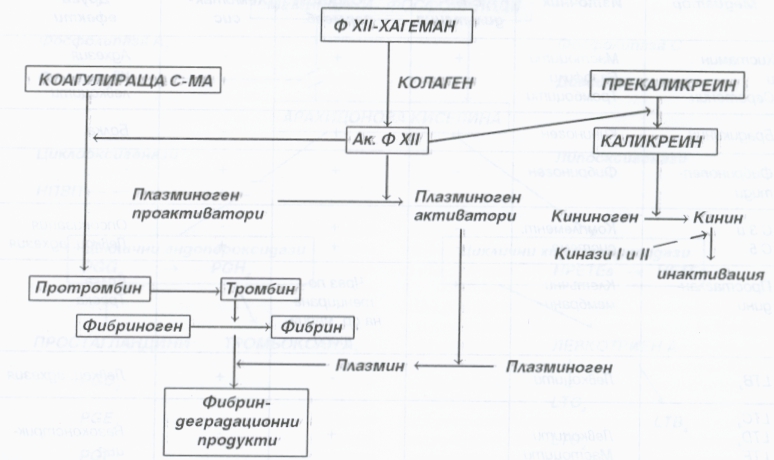
Системата на кръвосъсирването включва съсирващи и фибринолитични механизми. Тяхното отключване зависи от активацията на фактор 12 (факторът на Хагеман). Контактът на плазмата с отрицателно заредените повърхности (оголена базална мембрана, колаген, протеолитични ензими, липополизахаридни комплекси и чужди тела) обуславя моментаната активация на фактор 12. Той отключва процеса на кръвосъсирване. Крайният резултат е превръщането на разтворимия фибриноген в неразтворим фибрин. Обратният процес се нарича фибринолиза и води до превръщането на плазминогена в плазмин. Това става чрез пламиногенни активатори, отделящи се от ендотелните клетки, и чрез каликреина. Плазминът разгражда фибрина до различни разтворими фибриндеградационни продукти (фибринопептиди), които също повишават съдовата проницаемост и хемотаксиса на неутрофилните левкоцити. Следователно фактор 12 не само че отключва вътрешната система на кръвосъсирването и активира плазмените медиатори, но и самият той се явява като медиатор. Този фактор повишава съдовата проницаемост, усилва миграцията на неутрофилните левкоцити и агрегацията на тромбоцитите. По този начин системата на кръвосъсирване става компонент на възпалението, а факторът на Хагеман и тромбоцитите - свързващо звено в тези процеси.
Клетъчните елементи, които участват във възпалителната реакция, са неутрофилните левкоцити, моноцитите, макрофагите, лимфоцитите, както и мастоцитите, базофилните гранулоцити, тромбоцитите и ендотелните клетки. Те са важни източници на химични медиатори. Такъв медиатор е хистаминът - той предизвиква остра дилатация на съдовете на микроциркулацията, оток, увеличена слузна секреция и съкращаване на гладката мускулатура. Серотонинът (5-хидрокситриптамин) повишава проницаемостта на съдовите стени и води до съкращаване на гладкомускулните елементи. Цитокините участват във формиране на острия, но най-вече в хроничния възпалителен процес. Те са секреторен продукт на Т-лимфоцитите и макрофагите. Играят важна роля в нормалния имунен отговор и специално при тип 4 хиперергични реакции. Освен това участват в хроничния възпалителен отговор, в процесите на репарация и регенерация.
Интерферон У е важен фактор за активацията на макрофагите. Интерлевкин 1 е полипептид с маса около 15 000 Далтона и има най-голямо значение за лимфоцитната пролиферация в отговор на антигенната стимулация. Активира още фибробластите и колагеновата синтеза - паракринен ефект. Отговорен е за треската и за някои нарушения в белтъчния синтез (в черния дроб), които възникват при възпалението (ендокринен ефект).
Интерлевкин 6 е най-главният регулатор на чернодробния белтъчен синтез. Туморният некротизиращ фактор алфа (кахектин) стимулира скелетната мускулатура и катаболитните процеси в мастните клетки. Това води до загуба на тегло при всяко хронично възпаление. Интерлевкин 1 и туморнекротизиращият фактор алфа въздействат и върху ендотелните клетки за настъпване на левкоцитно - ендотелна адхезия. При увреждане на същите клетки, при което се разрушават клетъчните им или субкелтъчни мембрани, се освобождават кисели липиди, представляващи друг източник на медиатори.
Бавно реагиращата субстанция на анафилаксията включва различни левкотриени, предизвикващи дълготрайно съкращаване на гладката мускулатура и повишване на съдовата пропускливост. Еозинофилният хемотаксичен фактор А предизвиква тъканната еозинофилия. Тромбоцитният активиращ фактор предизвиква агрегация и дегранулация на тромбоцитите, повишава съдовия пермеабилитет, предизвиква адхезия на левкоцитите към ендотела и стимулира синтеза на дериватите на арахидоновата киселина.
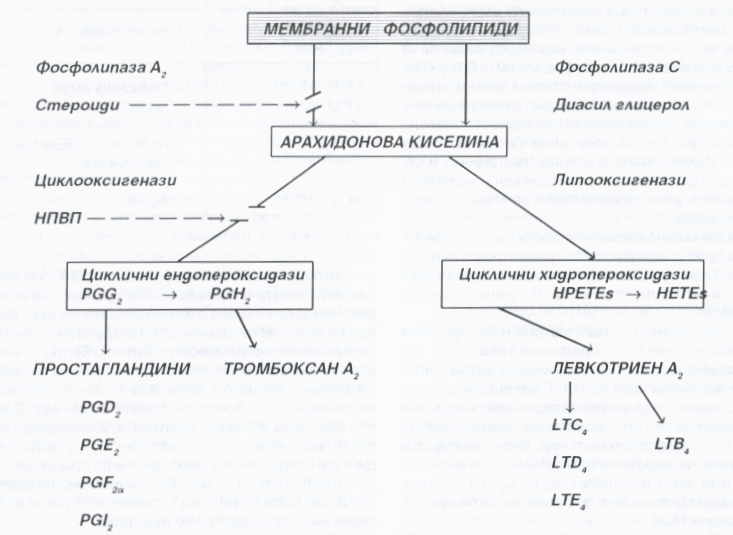
Простагландините са продукти от метаболизма на арахидоновата киселина. Притежават широк фармакологичен спектър на действие, както и пълен набор от свойства на медиатори на възпалението - увреждат съдовете на микроциркулацията, повишават проницаемостта на капилярите и венулите, усилват хемотаксиса и пролиферацията на фибробластите. Различните простагландини могат да регулират и интензитета на възпалителната реакция, като я усилват или подтискат.
Простагландините и левкотриените са метаболитни продукти на арахидоновата киселина. Тя е ненаситена мастна киселина, която участва в изграждането на фосфолипидните комплекси на клетъчните мембрани. Освобождава се при разрушаването на последните от двете фосфолипази, от които фосфолипаза А2 е с най-голямо участие във възпалението. Биологично активните продукти простагландини и левкотриени се получават при по-нататъшния метаболизъм на арахидоновата киселина. Те се редуцират чрез включване на интрацелуларните циклооксигенази и респективно на липооксигеназите. Какъв тип простагландин ще се продуцира се определя от вида на клетъчното или тъканното увреждане. Тромбоксан А2 и простагландин I2 (простациклин) са основните простагландини, синтезата на които е свързана с увреждане на тромбоцитите и ендотелните клетки. Поради това тези медиатори играят и важна роля в хемостазата. Простагландини PGD2, PGE2 и PGF2 се синтезират от макрофагите на неутрофилните левкоцити и причиняват вазодилатация. Простагландин Е2 предизвиква болка при интрадермално инжектиране участва във възникването на треската. Многообразието на дериватите на арахидоновата киселина определят многообразието на предизвикания от тях възпалителен отговор.
Антивъзпалителния ефект на нестероидните противовъзпалителни средства и на глюкокортикоидите се свързва с инхибиращото действие върху простагландиновата продукция. Глюкокортикоидите водят до синтез на белтъка липокортин (макрокортин, липомодулин), който инхибира активността на фосфолипаза А2. Аспиринът пък инхибира циклооксигеназната активност. Днес все още няма известни препарати, инхибиращи селективно липооксигеназния път на левкотриеновата продукция.
Според начина си на действие медиаторите са с директно (пряко) и индиректно (чрез посредник) действие. Директно действащи са хистамин, серотонин, бавно действащата субстанция на анафилаксията и някои простагландини. Тяхното действие при възпалението се осъществява най-рано. Индиректно действащи са компонентите на комплементарната система и лизозомалните ферменти. В хода на възпалителната реакция те се проявяват по-късно. Плазмените медиатори притежават много по-широк спектър на действие в сравнение с клетъчните медиатори. Те участват в процесите на съсирване и фибринолиза, както и в активирането на кининовата система. Освобождаването на медиаторите се осъществява по нецитолитичен (секреторен) път или цитолитично (чрез разрушване на клетъчната мембрана). Важна роля в този процес имат цикличните нуклеотиди. Фактори, стимулиращи аденилатциклазната система, например простагландин Е, увеличават нивото на цАМФ и се инхибира отделянето на медиатори. Обратно, намаляването на цАМФ ускорява този процес.
Процесът на освобождаване на медиатори при възпалителната реакция се осъществява главно на молекулно ниво, частично на субклетъчно и в още по-малка степен на клетъчно ниво. Това се отнася особено за морфологията на дегранулацията на мастоцитите и левкоцитите. В последните години се изказва предположението че цикличните нуклеотиди оказват ефекта си на действие благодарение на взаимодействието си с цитоплазмените микротубули. Установено е че под влиянието на деутериев оксид (който не е нищо друго, освен тежка вода), настъпва агрегация на микротубулите, която се съпровожда от усилено отделяне на хистамин и лизозомални ензими.
Вътреклетъчният ефект от действието на анафилатоксините, специално на С5а, се изразява в ускорено отделяне на лизозомални ензими. Този процес се съпровожда също от агрегация на микротубули. Колхицинът, който разрушава микротубулите, инхибира и отделянето на медиатори. Предполага се че благодарение на микротубулите се осъществява и действието на гранулите в цитоплазмата. Ролята на микротубулите се потвърждава и от косвени белези, наблюдаващи се при различните патологични процеси при човека. Например при синдрома на Чедиак - Хигаси се наблюдва нарушение на агрегацията на микротубулите в неутрофилните левкоцити, което обяснява тяхната нарушена фагоцитарна способност и като следствие - понижената резистентност на организма към инфекции. При въздействието на цАМФ и холинергичните субстанции върху неутрофилните левкоцити се възстановява способността на микротубулите за агрегация, а от там - и отделянето на медиатори на възпалението. Следователно процесът на отделяне на медиатори на възпалението е свързан с определени структури и има определена морфологична характеристика на клетъчно, субклетъчно и молекулярно ниво.