Възпалението е една от най-важните защитни реакции на организма. Терминът произхожда от латинския глагол inflammatore, който означава горя. В миналото практикуващите лекари са оприличавали възпалените органи и тъкани на горящ обект поради това че са затоплени и зачервени, поради което и наименованието се е наложило като медицински термин. Възпалението представлява сложна, комплексна, местна и обща реакция в организма в отговор на увреждането на органите и тъканите от различни патогенни фактори. Тя се развива в интерстициума на тъканите и органите при задължителното участие на микроциркулацията. Възпалителната реакция възниква за да локализира и елиминира вредния агент, да ограничи увреждането, а след това да възстанови тъканите до нормалното или близко до нормалното им състояние. Възпалението се явява като физиологичен отговор срещу увреждането; затова J. Hunter през 1794 година предлага възпалението само по себе си да не се разглежда като заболяване, а като полезна реакция на организма срещу някакво насилие или увреждане.
Лицево - челюстна хирургия Лечение на възпалението Клинични белези на възпалението Регенерация
По отношение на терминологията възпалителната природа на патологичните промени в органите и тъканите се означава като към името на съответната структура се прибави окончанието -itis - hepatitis, myocarditis, appendicitis, hepatitis etc. Има и известни изключения - така например възпалението на белите дробове се нарича pneumonia, а не pneumonitis. Целзиус е първият, който описва основните макроскопски клинични белези на възпалението - calor, rubor, tumor и dolor, съответно затопляне, зачервяване, подутина и болка. По-късно, едва през 19 век, Рудолф Вирхов добавя и още един признак - functio laesa, което означава нарушена функция на органа. Днес тези признаци се считат за класическо описание на кардиналните признаци на възпалението.
Възпалителната реакция е резултат от взаимодействието на организма с различни патогенни фактори от външната и вътрешната среда. Външните фактори са агресивни стимулатори, които увреждат организма - към тях се отнасят микроорганизми (бактерии, вируси, гъби, първаци, хелминти и други), токсични вещества (екзо- и ендотоксини), химични вещества (киселини и основи), механични фактори (травма, удар, проникване на чужди тела в организма), както и различни физични фактори - термични дразнители (студ или топлина) или йонизиращи лъчения. Лекарствените вещества също могат да предизвикват възпалителни реакции. Вътрешните фактори са автогенни дразнители, към които се причисляват продуктите на азотната обмяна (урея, пикочна киселина, ксантопротеинови тела), различни токсични обменни продукти, вещества от туморен разпад, ефекторни имунни клетки и имунни комплекси, отлагащи се в тъканите. Възпаление се предизвиква и в здравата тъкан в съседство с некротични лезии, предизвикани от различни причини, включително ангиогенни.
Възпалителната реакция е сложен и динамичен процес, който се развива като резултат от взаимосвързани и последователно протичащи фази. Първата фаза е тази на увреждането (алтерация) - времето на прякото действие на патогенния причинител върху клетките и тъканите. Съществуването на тази фаза нерядко се оспорва от специалистите, тъй като тя не винаги може да бъде доказана и документирана. Следва ексудативната фаза - тя настъпва в резултат на нарушения в микроциркулацията и състава на кръвта. В резултат на това се образува тъканен излив (ексудат). Последна е пролиферативната фаза, при която настъпва клетъчно разрастване. Тази фаза може да завърши с пълно възстановяване на тъканите или с образуване на цикатрикс.
Зъбни импланти Зъболекар Ела Меки тъкани Кост Остро възпаление Хронично възпаление
При развитието на възпалителния процес е възможно в даден етап да доминира някоя от трите фази - поради което и се срещат предимно алтеративни, ексудативни или пролиферативни възпаления. Продължителността на алтеративната фаза е много кратка. Микроциркулаторните промени възникват бързо, поради което не е възможно да се установи границата между алтерацията и ексудацията. Поради това самостоятелно алтеративно възпаление се среща много рядко - единствено при много увредени (терминални) пациенти, при които реактивността на организма е слаба и в клиничната картина на преден план излиза единствено действието на увреждащия агент.
Възпалителният фактор уврежда клетките и тъканите и обуславя понижаването на тяхната жизнена дейност. Под влияние на агресивния агент обмяната на веществата в тъканите леко се повишава, но след това бързо се подтиска. По-късно се развиват дегенеративни промени, които могат да прогресират до некротични лезии. Настъпва и дезорганизация на основното вещество и влакнестите структури на съединителната тъкан с натрупване на свободни аминокиселини, полипептиди, нискомолекулни въглехидрати, разпадни продукти (млечна киселина) и развитие на тъканна ацидоза. При всички тези процеси основно значение имат лизозомните ензими, отделени от увредените клетки, а впоследствие и от появяващите се в огнището на възпалението левкоцити и макрофаги.
Обменните нарушения и включването на ензимните реакции предизвикват появата на биологично активни вещества (медиатори). Те са едни от най-важните компоненти на възпалителната реакция. Източници на тези медиатори са плазмата и клетките - циркулиращи тромбоцити, баозфилните и еозинофилните гранулоцити, лимфоцити, макрофаги, тъканни мастоцити, невроендокринните клетки. Плазмените медиатори включват три системи - кининовата, комплементарната и системата на кръвосъсирване. В кръвта тези системи се намират в неактивно състояние, на ниво предшественици и се активират под действието на определени фактори. В плазмата съществува и инхибираща активацията система, поради което се постига сравнително равновесие между тях.
В изграждането на кининовата система участват брадикинин и каликреин, които са нискомолекулни пептиди. Брадикининът е най-добре изследван и характеризиран. Той има изразен хипотензивен ефект и силно повишава съдовата проницаемост. Обуславя чувството за болка в огнището на възпалението. Каликреинът участва в хемотаксичната активност на неутрофилните левкоцити и притежава способност за реципрочна активация на фактора на Хагеман (фактор 12 на кървосъсирващата система). Кининовата активация се регулира от карбоксипептидазата (киназа 1), а киназа 2 бързо инактивира фактора.
Комплементарната система е група от 20 плазмени протеини, които играят важна роля в защитата на организма срещу бактериални инфекции и като медиатор във възпалителния отговор. Системата може да се активира от два независими от друг пътя - класически и алтернативен. Активацията на комплемента по всеки един от тези два пътя води до образуване на ензими, които активират третия или петия компонент от системата - С3 или С5. Този процес генерира комплекс, който атакува клетъчната мембрана и причинява лизиране на клетките. По време на активацията се освобождават много от биологично активните субферменти на системата - С3а, С4а, С5а.
Класическият път на активацията на комплемента се включва под въздейтвие на антиген - антитяло комплексите, съдържащи IgM или IgG, бактериални продукти и вируси. Активацията започва с прикрепването на първия компонент на комплемента - С1, който пептид се състои от три по-малки молекули - C1q, C1r и C1s. Прикрепването се осъществява към фракцията C1q. Молекулата C1s активира компонентите С2 и С4. От С4 се освобождава малкият фрагмент С4а и голяма част от молекулата на С4в, която се прикрепва ковалентно към повърхността на активиращия агент. С2 се захваща към С4в. Полученият бимолекулярен комплекс С4в2а е активиращият ензим С3 - конвертаза, който активира С3 и освобождава от един малък фрагмент С3а и по-голям С3в, който също се свързва ковалентно към повърхността на антивиращия агент. Формира се нов, мултимолекулен комплекс С4в2а3в. Това е така наречената С5 - конвертаза, която активира С5, освобождава С5а и дава възможност С5в да се свърже временно към повръхността на агента. С5в действа като център, около който последователно се свързват агентите С6, С7, С8 и С9. Така се формира цитолитично мембранно - атакуващ комплекс (МАК). Той е силно хидрофобен и пенетрира в клетъчната мембрана. Електронномикроскопски се вижда като кух цилиндър, който преминава през мембраната. Разрушаването на клетъчната мембрана води до цитолиза.
Алтернативният път за активация на комплемента също се активира от бактерии и други микроорганизми. Фрагментите С1, С2 и С4 не участват в този път. Този път стартира след продължителен нискостепенен кръговрат на С3 - фрагмента, при който под действието на контролен ензим (фактор 1 и неговият кофактор Н) се образува С3в - фрагментът. При класическия път този фрагмент се свързва ковалентно с повърхността на активиращия агент, но тук тук факторът избягва този регулаторен ефект и се свързва с фактор В. Последният се разцепва от фактор Д и се освобождава фрагментът Ва, докато фрагментът Вв остава свързан с С3 под формата на нестабилна конвертаза - С3вВв, наречена още С3 - конвертаза на алтернативния път. Тя се стабилизира от един протеин - пропердин, в комплекс С3вВвР, наречен пропердин - стабилизирана конвертаза на алтернативния път. Този комплекс активира С3 и С5 за формиране на МАК по идентичен на класическия път механизъм.
Пептидите С3а, С4а и С5а се наричат анафилатоксини (ААФ). Те причиняват гладкомускулна контракция и увеличават съдовата проницаемост. Последният ефект отчасти е моделиран от секрецията на хистамин в момента на взаимодействие на ААФ с мастоцитите и базофилните клетки. С5а е с най-силна, а С4а е с най-слаба анафилатоксична активност. С5а е най-мощният хемотаксичен фактор за неутрофилните левкоцити, еозинофилите, базофилите и моноцитите. Той стимулира също неутрофилната дегранулация и супероксидната продукция.
Системата на кръвосъсирването включва съсирващи и фибринолитични механизми. Тяхното отключване зависи от активацията на фактор 12 (факторът на Хагеман). Контактът на плазмата с отрицателно заредените повърхности (оголена базална мембрана, колаген, протеолитични ензими, липополизахаридни комплекси и чужди тела) обуславя моментаната активация на фактор 12. Той отключва процеса на кръвосъсирване. Крайният резултат е превръщането на разтворимия фибриноген в неразтворим фибрин. Обратният процес се нарича фибринолиза и води до превръщането на плазминогена в плазмин. Това става чрез пламиногенни активатори, отделящи се от ендотелните клетки, и чрез каликреина. Плазминът разгражда фибрина до различни разтворими фибриндеградационни продукти (фибринопептиди), които също повишават съдовата проницаемост и хемотаксиса на неутрофилните левкоцити. Следователно фактор 12 не само че отключва вътрешната система на кръвосъсирването и активира плазмените медиатори, но и самият той се явява като медиатор. Този фактор повишава съдовата проницаемост, усилва миграцията на неутрофилните левкоцити и агрегацията на тромбоцитите. По този начин системата на кръвосъсирване става компонент на възпалението, а факторът на Хагеман и тромбоцитите - свързващо звено в тези процеси.
Клетъчните елементи, които участват във възпалителната реакция, са неутрофилните левкоцити, моноцитите, макрофагите, лимфоцитите, както и мастоцитите, базофилните гранулоцити, тромбоцитите и ендотелните клетки. Те са важни източници на химични медиатори. Такъв медиатор е хистаминът - той предизвиква остра дилатация на съдовете на микроциркулацията, оток, увеличена слузна секреция и съкращаване на гладката мускулатура. Серотонинът (5-хидрокситриптамин) повишава проницаемостта на съдовите стени и води до съкращаване на гладкомускулните елементи. Цитокините участват във формиране на острия, но най-вече в хроничния възпалителен процес. Те са секреторен продукт на Т-лимфоцитите и макрофагите. Играят важна роля в нормалния имунен отговор и специално при тип 4 хиперергични реакции. Освен това участват в хроничния възпалителен отговор, в процесите на репарация и регенерация.
Интерферон У е важен фактор за активацията на макрофагите. Интерлевкин 1 е полипептид с маса около 15 000 Далтона и има най-голямо значение за лимфоцитната пролиферация в отговор на антигенната стимулация. Активира още фибробластите и колагеновата синтеза - паракринен ефект. Отговорен е за треската и за някои нарушения в белтъчния синтез (в черния дроб), които възникват при възпалението (ендокринен ефект).
Интерлевкин 6 е най-главният регулатор на чернодробния белтъчен синтез. Туморният некротизиращ фактор алфа (кахектин) стимулира скелетната мускулатура и катаболитните процеси в мастните клетки. Това води до загуба на тегло при всяко хронично възпаление. Интерлевкин 1 и туморнекротизиращият фактор алфа въздействат и върху ендотелните клетки за настъпване на левкоцитно - ендотелна адхезия. При увреждане на същите клетки, при което се разрушават клетъчните им или субкелтъчни мембрани, се освобождават кисели липиди, представляващи друг източник на медиатори.
Бавно реагиращата субстанция на анафилаксията включва различни левкотриени, предизвикващи дълготрайно съкращаване на гладката мускулатура и повишване на съдовата пропускливост. Еозинофилният хемотаксичен фактор А предизвиква тъканната еозинофилия. Тромбоцитният активиращ фактор предизвиква агрегация и дегранулация на тромбоцитите, повишава съдовия пермеабилитет, предизвиква адхезия на левкоцитите към ендотела и стимулира синтеза на дериватите на арахидоновата киселина.
Простагландините са продукти от метаболизма на арахидоновата киселина. Притежават широк фармакологичен спектър на действие, както и пълен набор от свойства на медиатори на възпалението - увреждат съдовете на микроциркулацията, повишават проницаемостта на капилярите и венулите, усилват хемотаксиса и пролиферацията на фибробластите. Различните простагландини могат да регулират и интензитета на възпалителната реакция, като я усилват или подтискат.
Цитоплазмените гранули на неутрофилите и моноцитите съдържат протеази - колагеназа, еластаза, катепсини, които се отделят при възпалението и предизвикват дезорганизация на клетъчния матрикс - колагена, базалните мембрани и еластина. Плазминът се образува под действието на плазмин - активаторите и играе също голяма роля в деструкцията на съединителнотъканния матрикс.
Неутрофилните левкоцити секретират и хетерогенна група катионни протеини, които повишават съдовия пермеабилитет чрез директно увреждане на ендотела или индиректно, чрез освобождаване на хистамин от мастоцитите. Освобождаване на реактивни кислородни метаболити от неутрофилите и макрофагите обуславя също увреждането на еднотелните клетки с увеличаване на пропускливостта на съдовата стена. Кислородните метаболити увреждат и други клетки или матриксни компоненти.
Тромбоцитите са малки безядрени клетки - имат диаметър около 2 микрометра. Съдържат три типа гранули - тъмни, богати на серотонин, хистамин, калциеви йони и АДФ. Срещат се и алфа - гранули, в които има фибриноген, коагулиращи белтъци, тромбоцитен растежен фактор, други пептиди и протеини. Третият тип гранули са лизозомните, които съдържат кисели хидролази. Когато тромбоцитите влязат в контакт с фибрите на колагена (при съдови лезии) или с тромбина (при активация на системата на кръвосъсирването), настъпва процес на адхезия, агрегация и дегранулация. Това може да се случи и при контакт с антиген - антитяло комплекси, анафилатоксини и мастоцитни гранули. Дегранулацията освобождава основно серотонин и хистамин, действащи директно върйу съдовия пермеабилитет. Освен това при разрушаване на клетъчната мембрана се включва метаболизирането на арахидоновата киселина и се продуцира тромбоксан А2. Простагландинът освен ролята на вторичен усилващ тромбоцитната агрегация фактор притежава и съкратителни свойства върху гладката мускулатура.
Мастоцитите и базофилните гранулоцити са другият сериозен източник на вазоактивни медиатори. Това са основно хистамин, хепарин, хемотаксични медиатори за неутрофилните и еозинофилните гранулоцити. Дегранулацията на тези клетки започва с прикрепването на антигена към предварително фиксираните върху клетъчната им мембрана IgE - имуноглобулини и въздействието на анафилатоксините, освобождаващи се от комплементарната система - фрагменти С3а и С5а. Специфичните медиатори на тези клетки играят важна роля. Те регулират съдовия пермеабилитет и бронхиалната гладкомускулна активност, особено при някои форми на алергични (хиперергични) реакции. Инжектирани в кожата, хистаминът и серотонинът предизвикват реверзибелна еднотелна контракция с разширяване на пространствата между клетките и оток.
Действието на хистамина върху съдовете се реализира чрез специфични Н1 - рецептори в съдовата стена. Този ефект може да се инхибира чрез фармакодинамичното действие на Н1 - рецепторните антагонисти. Дегранулацията на мастоцитите и базофилните гранулоцити може да се предизвиква също и от физични агонисти като злато, травма, както и от лизозомалните ензими на неутрофилните левкоцити. Стимулацията и дегранулацията на тези клетки води и до освобождаване на продукти на метаболизма на арахидоновата киселина, включително и така наречената бавно действаща субстанция на анафилаксията. Тя включва различните левкотриени (С4, D, Е4), предизвикващи контракция и повишен съдов пермеабилитет.
Простагландините и левкотриените са метаболитни продукти на арахидоновата киселина. Тя е ненаситена мастна киселина, която участва в изграждането на фосфолипидните комплекси на клетъчните мембрани. Освобождава се при разрушаването на последните от двете фосфолипази, от които фосфолипаза А2 е с най-голямо участие във възпалението. Биологично активните продукти простагландини и левкотриени се получават при по-нататъшния метаболизъм на арахидоновата киселина. Те се редуцират чрез включване на интрацелуларните циклооксигенази и респективно на липооксигеназите. Какъв тип простагландин ще се продуцира се определя от вида на клетъчното или тъканното увреждане. Тромбоксан А2 и простагландин I2 (простациклин) са основните простагландини, синтезата на които е свързана с увреждане на тромбоцитите и ендотелните клетки. Поради това тези медиатори играят и важна роля в хемостазата. Простагландини PGD2, PGE2 и PGF2 се синтезират от макрофагите на неутрофилните левкоцити и причиняват вазодилатация. Простагландин Е2 предизвиква болка при интрадермално инжектиране участва във възникването на треската. Многообразието на дериватите на арахидоновата киселина определят многообразието на предизвикания от тях възпалителен отговор.
Антивъзпалителния ефект на нестероидните противовъзпалителни средства и на глюкокортикоидите се свързва с инхибиращото действие върху простагландиновата продукция. Глюкокортикоидите водят до синтез на белтъка липокортин (макрокортин, липомодулин), който инхибира активността на фосфолипаза А2. Аспиринът пък инхибира циклооксигеназната активност. Днес все още няма известни препарати, инхибиращи селективно липооксигеназния път на левкотриеновата продукция.
Според начина си на действие медиаторите са с директно (пряко) и индиректно (чрез посредник) действие. Директно действащи са хистамин, серотонин, бавно действащата субстанция на анафилаксията и някои простагландини. Тяхното действие при възпалението се осъществява най-рано. Индиректно действащи са компонентите на комплементарната система и лизозомалните ферменти. В хода на възпалителната реакция те се проявяват по-късно. Плазмените медиатори притежават много по-широк спектър на действие в сравнение с клетъчните медиатори. Те участват в процесите на съсирване и фибринолиза, както и в активирането на кининовата система. Освобождаването на медиаторите се осъществява по нецитолитичен (секреторен) път или цитолитично (чрез разрушване на клетъчната мембрана). Важна роля в този процес имат цикличните нуклеотиди. Фактори, стимулиращи аденилатциклазната система, например простагландин Е, увеличават нивото на цАМФ и се инхибира отделянето на медиатори. Обратно, намаляването на цАМФ ускорява този процес.
Процесът на освобождаване на медиатори при възпалителната реакция се осъществява главно на молекулно ниво, частично на субклетъчно и в още по-малка степен на клетъчно ниво. Това се отнася особено за морфологията на дегранулацията на мастоцитите и левкоцитите. В последните години се изказва предположението че цикличните нуклеотиди оказват ефекта си на действие благодарение на взаимодействието си с цитоплазмените микротубули. Установено е че под влиянието на деутериев оксид (който не е нищо друго, освен тежка вода), настъпва агрегация на микротубулите, която се съпровожда от усилено отделяне на хистамин и лизозомални ензими.
Вътреклетъчният ефект от действието на анафилатоксините, специално на С5а, се изразява в ускорено отделяне на лизозомални ензими. Този процес се съпровожда също от агрегация на микротубули. Колхицинът, който разрушава микротубулите, инхибира и отделянето на медиатори. Предполага се че благодарение на микротубулите се осъществява и действието на гранулите в цитоплазмата. Ролята на микротубулите се потвърждава и от косвени белези, наблюдаващи се при различните патологични процеси при човека. Например при синдрома на Чедиак - Хигаси се наблюдва нарушение на агрегацията на микротубулите в неутрофилните левкоцити, което обяснява тяхната нарушена фагоцитарна способност и като следствие - понижената резистентност на организма към инфекции. При въздействието на цАМФ и холинергичните субстанции върху неутрофилните левкоцити се възстановява способността на микротубулите за агрегация, а от там - и отделянето на медиатори на възпалението. Следователно процесът на отделяне на медиатори на възпалението е свързан с определени структури и има определена морфологична характеристика на клетъчно, субклетъчно и молекулярно ниво.
От патологоанатомична гледна точка възпалението протича в две основни форми - остра и хронична. Те зависят от персистирането на увреждащия агент, от клиничната симптоматика и от природата (характера) на възпалителния отговор. Острото възпаление представлява бърза реакция, която се развива в рамките на часове, дни, рядко от порядъка на месеци. Независимо от многообразието на факторите, които предизвикват острото възпаление, непосредствената тъканна реакция е стереотипна.
Локално острото възпаление се проявява с нарушения на микроциркулацията, главно на ниво капиляри и посткапилярни венули. То се изразява в излив на плазма и плазмени белтъци, включени са и левкоцити. Първоначално се появяват полинуклеарни гранулоцити, последвани от моноцити, лимфоцити, тромбоцити и еритроцити. Стереотипността на реакциите при острото възпаление се определя от освобождаването на химичните медиатори. Те въздействат върху съдовия ендотел, като нарушават интегритета между ендотелните клетки и повишават съдовия пермеабилитет. Медиаторите на възпалението имат хемотаксичен ефект върху левкоцитите. Те обуславят и активация на процеса на фагоцитоза до унищожаването на причинителя. Левкоцитите освобождават също химични агенти, които могат да задълбочат тъканните увреждания. Първоначалните нарушения в участъка на възпалението се съпровождат след това от кръвна стаза и формирането на микротромби.
Реактивните промени, които възникват в тъканите в първите няколко часа след въздействието на увреждащия агент, включват три процеса - промени в съдовия калибър и кръвния ток, повишен пермеабилитет на съдовата стена и формиране на възпалителен ексудат и излизане на левкоцити от съдовете в интерстициалното пространство. Трите процеса се проявяват с излив на ексудат в зоната на тъканното увреждане, който съдържа богата на белтъци оточна течност, фибрин и левкоцити.
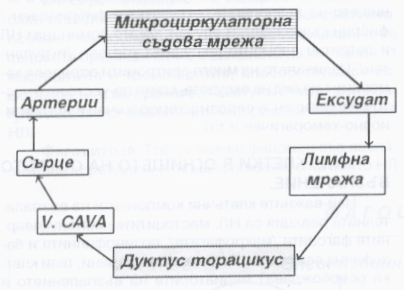
Кръвта преминава в микроциркулаторната мрежа от артериолите към широките и тънкостенни венули. Капилярите са свъзващото звено между артериолите и венулите на нивото на микроциркулаторното съдово русло. В прехода към капиляр стената на артериолата има циркулаторен, мощен гладкомускулен слой, играещ ролята на сфинктер. Той регулира протичането на кръвта през самите капиляри. Тяхната стена е тапицирана с непрекъснат ендотелен слой, разположен върху базалната мембрана. В стената липсват гладкомускулни елементи. В много органи (ендокринни и екзокринни жлези, бъбреци, тънкочревната лигавица, чернодробните синусоиди и тези на слезката, костномозъчните синуси) ендотелната тапицировка е фенестрирана, т.е. между клетките има широки отвори. Някои капиляри са по-големи от другите и формират особени канали, през които при нормални условия кръвта протича с предимство. В останалата капилярна мрежа кръвотокът е променлив и се регулира от контракцията и релаксацията на прекапилярните сфинктери. Заради малкия диаметър на капилярния лумен движението на еритроцитите е поединично, в стълб, поради което те често се деформират. В по-широките артериоли и венули ламинарният характер на кръвния ток осигурява централно разположение на кръвните елементи и плазмен, свободен от клетки слой непосредствено до съдовата стена - това се нарича аксиален кръвен ток.
При клетъчна и тъканна (органна) активност, например при секрецията на жлезите, абсорбция в чревния епител, мускулно съкращение и други, прекапилярните сфинктери се отпускат, капилярите се отварят и кръвонапълват, за да отговорят на метаболитните потребности на организма. Движението на кръвния ток в артериолите и венулите се регулира от нервни и хуморални механизми, докато в терминалната съдова мрежа (капилярите) локално продуцираните метаболити модулират кръвния ток чрез ефекта си върху прекапилярните сфинктери.
Въздействието на увреждащия агент води до бърза, транзиторна вазоконстрикция на артериолите, която не винаги е възможно да бъде открита при клинични условия - затова и се спори дали изобщо съществува алтеративна фаза на възпалението. Тя се последва от масивна вазодилатация на артериолите и венулите. Наблюдава се отваряне на капилярите и на онези най-малки съдове, които при нормални условия са изключени от общия кръвен ток (резервни капиляри). В резултат на това полседва активна възпалителна хиперемия, като увредената зона силно се кръвоснабдява. Отначало снабдяването с кръв е много бързо, с турбулентен характер, но само след 10 - 15 минути се забавя и се възвръща до нормалното. Фазата на увеличен кръвен ток се последва от неговото намаляване и забавяне. В някои случаи настъпва стаза в съдовете. Причина за последното е нарастналият вискозитет на кръвта в миркоциркулацията поради загуба на плазмена течност от посткапилярните веннули, т.е. настъпва местна хемоконцентрация. Други фактори, които способстват за развитието на стазата, са повишеното тъканно налягане (поради излятата плазма, компресираща съдовата стена) и адхезия на левкоцитите към ендотела, с която се ограничава съдовият лумен.
Повишената съдова проницаемост води до ексудация на плазма и емиграция на клетки, т.е. до формиране на ексудат. Образуването на този ексудат зависи от излива на течност и белтъчни молекули през стената на съдовете на микроциркулацията. При нормални условия дифузията на малки молекули се осъществява чрез концентрационния им градиент - така се осъществява движението през съдовата стена и тъканите и обратно, включително на кислород и въглероден диоксид. За големите молекули дифузията е толкова бавна, че няма практическо значение. Следователно ултрафилтрацията е за сметка на течностите и нискомолекулните разтворими вещества. Още през 1896 година Старлинг доказва че транспортът през съдовата стена е резултат от динамичното равновесие между хидростатичното налягане и колоидо - осмотичното налягане. При нормални условия хидростатичното налягане в артериоларния край на капилярите превишава плазменото осмотично налягане, което е осигурено главно от албумините, при което течностите напускат съда. В същото време с намаляване на хидростатичното налягане и запазване на осмотичното течността отново се увлича обратно в съдовете. Това движение отвътре навън и обратно протича приблизително в еднаква степен, поради което в тъканите течност не се натрупва. При възпаление дилатацията на артериолите се изразява в нарастване и поддържане на високо интраваскуларно хидростатично налягане в микроциркулацията. Течността напуска съдовете по цялата дължина на микроциркулаторната мрежа, със слаба или изобщо липсваща обратна резорбция на излятата течност в тъканите. Въпреки това някои белтъци с по-малка молекулна маса излизат от малките съдове; при нормални условия тяхното количество винаги е минимално, особено при съдове, тапицирани с непрекъснат ендотелен слой. Също така тези молекули при липса на възпаление бързо се връщат в циркулацията чрез лимфната мрежа. Обратно, при наличие на възпаление големи количества плазмени протеини напускат кръвоносните съдове. Осмотичното налягане спада, с което също се затруднява връщането на течността в съдовете. ПРедполага се че излизането на белтъчните молекули се осъществява през ендотелните клетки основно чрез пиноцитозни везикули. Днес вече е доказано че при липса на директно съдово увреждане плазмените протеини напускат съда през междуендотелните пространства на посткапилярните венули. Вазоактивните медиатори въздействат върху ендотелните клетки и причиняват контракция и разширяване на пространствата между тях.
В огнището на възпалението се натрупва богата на белтъци течност - това е така нареченият възпалителен ексудат, който съдържа предимно плазмени белтъци в концентрация около 35 - 50 грама на литър. При контакта си с екстравазалното тъканно пространство коагулационната система се активира и неразтвореният фибриноген в ексудата се превръща във фибрин. Чрез лимфния дренаж на участъка ексудатът бързо се връща отново в микроциркулацията и се поддържа непрекъснат обмен между тъканта и съдовете. Количеството на ексудата в тъканите зависи от техния вид - в компактни, плътни тъкани, фиброзни капсули и други се изливат обикновено малки количества ексудат, които обаче бързо увеличават напрежението и налягането в участъка. При рехави тъкани или в телесни кухини се натрупват големи количества ексудат без особено нарастване на тъканното налягане. Изливът на плазмени белтъци се последва от емиграция на кръвни елементи, които се прибавят към оформящия се ексудат и представляват задължителен негов елемент.

Схема на процеса на формиране и резорбция на възпалителния ексудат. Лимфната система играе основна роля при него - както се вижда, резорбцията на ексудата се осъществява най-вече по хода на лимфните съдове. При това инфекциозните агенти преминават поне през три последователни лимфни възела, където са подложени на допълнителна обработка от страна на имунната система. Клинично това се демонстрира като увеличен и затоплен регионален лимфен възел в зоната на възпалението, но понякога и доста отдалечено - най-вече при по-тежки инфекции, при които имунната система не успява да се справи с локалния инфекциозен процес.
Освен това от съдовете излизат левкоцити и мигрират към посоката на увреждането, което всъщност представлява най-важният момент от формирането на острия възпалителен отговор. Неутрофилните левкоцити мигрират първи, в най-ранния стадий на възпалителната реакция. Преминаването им през съдовата стена се предхожда от подготвителен стадий и протича на няколко етапа - маргинация, селекция на неутрофилните гранулоцити, миграция и хемотаксис. Маргинацията означава че левкоцитите преминават от осевия цилиндър на кръвния ток към периферната част до съдовата стена; следва адхезия към ендотела на посткапилярните венули. Този процес се благоприятства от застоя на кръвния ток в микроциркулаторната мрежа в огнището на възпалението.
В процеса на адхезия основна роля има селекцията на левкоцитите и след това взаимодействието им с ендотелните клетки. Тази селекция се осъществява по рецепторнозависими механизми чрез адхезивните молекули 1 (ELAM 1) и тромбоцитактивиращозависим външен мембранен протеин 140 (GMP - 140). Най-ранната левкоцитна маргинация се осъществява като отговор на експресията на този протеин върху ендотелната клетъчна мембрана. Нормално белтъкът се съхранява в телцата на Weibel - Palade на ендотелните клетки. При стимулация той бързо се транслоцира върху клетъчната мембрана и взаимодейства със съответните рецептори на неутрофилните гранулоцити. В това взаимодействие има известна избирателност - например неутрофилните гранулоцити, отчасти моноцитите и еозинофилните гранулоцити, прилепват главно към стените на възпалените венули, докато лимфоцитите, експресиращи ELAM 1 - до ендотела на венулите в нормалната, отчасти в хронично възпалената лимфна тъкан.
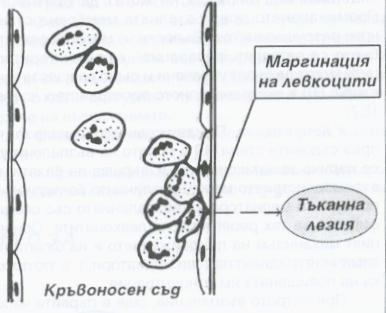
Схема на процеса на маргинация на левкоцитите - те се подреждат покрай стената на кръвоносния съд и се групират по няколко клетки. Обикновено това групиране се случва в участък, който е разположен най-близо до тъканната лезия.
Скоро след това маргинално разположените левкоцити мигрират през стената на венулите и малките вени и отчасти през капилярната стена. Миграцията през съдовата стена се осъществява чрез амебовидни движения. Неутрофилният левкоцит формира псевдоподи, които навлизат между разширените междуендотелни връзки и постепенно увличат цялата клетка. Преди да преминат през базалната мембрана, неутрофилните гранулоцити се разполагат под ендотелните клетки. Самата базална мембрана представлява по-голямо препятствие и поради това левкоцитът може дълго да се задържи под нея без да премине; следва разрушаване на базалната мембрана и клетката излиза извън капилярите. Въпреки че микродефектите бързо се затварят (репарация), единични еритроцити могат да бъдат увлечени и също да излязат в екстравазалното пространство.
Придвижването на излезлите през съдовата стена неутрофилни левкоцити в полето на възпалението се нарича хемотаксис и се извършва на базата на взаимодействието между различните бактериални продукти и медиатори на възпалението със специфичните за тях рецептори на левкоцитите. Основният механизъм на придвижването е на базата на химичния градиент на тези медиатори, т.е. по посока на повишената им концентрация. При острото възпаление още в първите часове на формиране на възпалителната реакция доминиращите клетки са неутрофилните гранулоцити. Те започват да акумулират в полето на възпалението дори още през алтеративната фаза на възпалителния процес. Моноцитите излизат и се натрупват в огнището по-късно, в последните 24 часа от началото на възпалението. При определени агенти са възможни и изключения от тази последователност - например първоначално доминиране на еозинофилни гранулоцити при паразитни инфекции, на лимфоцити при вирусни заболявания, персистиране на неутрофилни левкоцити при някои бактериални инфекции, например стафилококи, и т.н. Най-важните хемотаксични фактори са С5а - фрагментът на комплемента, нискомолекулярните N-формилирани пептиди (N - формил-метионил-левцил-фенилаланин), както и специфични продукти от липидния метаболизъм, включително и левкотриени. Хемотаксични фактори са и продуктите от увредените тъкани - лимфокини, които се секретират от лимфоцитите, както и някои монокини - секреторни продукти на моноцитите и тъканните макрофаги.
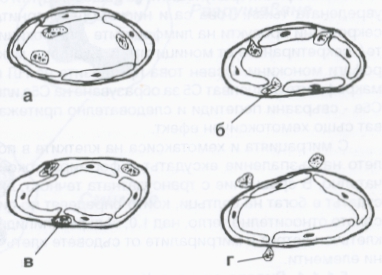
Процес на миграция на левкоцитите извън кръвоносния съд. Това представлява важен физиологичен (а при някои условия - и патофизиологичен) механизъм, по който всеки един жив организъм осъществява своята защита против инфекциозни агенти. Във фаза а) се извършва маргинацията не левкоцитите, описана по-горе; във фаза б) те преминават между ендотелните клетки, във фаза в) е показана пенетрацията на базалната мембрана и във фаза г) левкоцитите са вече извън капилярите - под въздействие на различни хемотаксични фактори те се насочват към мястото на увреждането в тъканите.
С миграцията и хемотаксиса на клетките в полето на възпаление ексудатът е формиран окончателно. В сравнение с трансудатната течност той е богат на белтъци, които определят по-високо относително тегло, съдържа и липиди, клетъчен детрит и мигриралите от съдовете клетъчни елементи. Когато съдържанието на последните е ниско, се говори за серозен ексудат; при излив на по-голямо количество фибриноген в тъканите и активиране на каскадата на кръвосъсирването ексудатът става фибринозен. В случаи, в които доминират неутрофилните гранулоцити и детритни елементи, ексудатът е гноен (пурулентен). При излив на повече еритроцити се говори за хеморагичен характер на ексудата. Чисто хеморагичен ексудат се среща рядко, по-често има смесен характер - серозно - хеморагичен или фибринозно - хеморагичен.
При острото възпаление най-важните клетъчни компоненти са неутрофилните гранулоцити, мастоцитите, еозинофилните и базофилните левкоцити. Когато се стимулират еднократно, тези клетки освобождават медиаторите на възпалението и причиняват задълбочаването на тъканното увреждане. Неутрофилните левкоцити се активират в отговор на фагоцитарни стимули или чрез захващане на хемотаксични медиатори, или чрез прикрепване на антиген - антитяло свързани комплекси към специфични рецептори на техните клетъчни мембрани. Освен това неутрофилните левкоцити имат други рецептори, с които се свързват към FC - веригата на антителата IgG и IgM, с компонентите С5а и С3в на системата на комплемента, с левкотриените и с формираните нискомолекулни хемотаксични пептиди. В резултат на това те осъществяват функциите си в полето на възпалението.
Микроскопски неутрофилните гранулоцити изглеждат като малки клетки, с диаметър от порядъка на 10 микрометра. Предшествениците им от костния мозък попадат в кръвта, където те циркулират само за няколко часа и бързо преминават в лигавиците, където осъществяват основната си функция - антимикробна защита. Те бързо фагоцитират голям брой бактерии и загиват, поради което съзряват ускорено в областта на костния мозък - за период от само 14 дни. В цитоплазмата си съдържат азурофилни гранули - това всъщност са лизозоми, които съдържат неутрални и кисели хидролази - ензими, които предизвикват хидролиза на различни вътре- и извънклетъчни молекули. Под действие на С5а - фактора на комплемента се освобождават ензими от тези гранули, които са водещи при определянето на миркоскопската картина на възпалението както в при нормален, така и при сенсибилизиран организъм. Изключително голяма роля при този процес играят неутралната протеаза, еластазата и колагеназата. От активността на тези ензими зависи дълбочината на увреждането и съответно интензитетът на възпалителната реакция.
Активността на неутралните протеази на неутрофилните левкоцити се инхибира от серумните протеази - L1 - антитрипсин, L2 - макроглобулин и L1 - антихимотрипсин. При дефицит на инхибиторите, който може да е генетично обусловен, резистентността на тъканите срещу увреждането е понижена.
Неутрофилните гранулоцити съдържат в цитоплазмата си и специфични гранули. В тях се откриват главно АФ и бактериални катионни белтъци. Освобождаването, особено на последните, осигурява повишаване на съдовата проницаемост, отделяне на хистамин от мастоцитите и тромбоцитите, способства се хемотаксисът и се проявяват антикоагулантните, коагулантните, пирогенните и антибактериални свойства на неутрофилите.
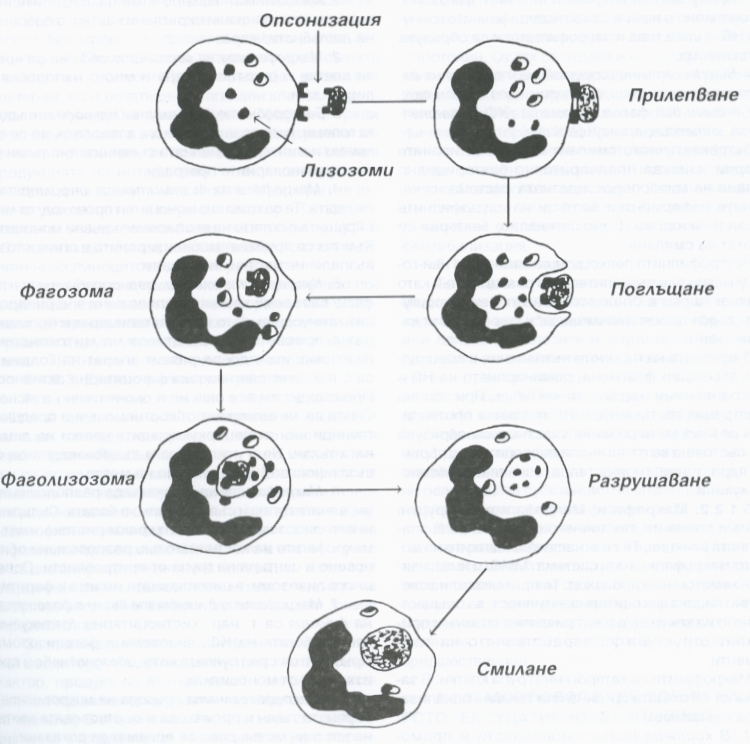
Схема на фагоцитозата - тя е важен елемент на възпалителната реакция, в осъществяването на който неутрофилните гранулоцити играят важна роля. При този процес става поглъщане на бактерии и продукти на тъканния и клетъчен разпад и се осъществява тяхното по-нататъшно смилане. Фагоцитозата далеч не във всички случаи се явява полезен процес за организма - в някои случаи бактериите се натрупват във фагиращите клетки на организма и дори се размножават (например при лепра и гонорея), с което се осигурява прогресиране и хронифициране на възпалението.
Фагоцитозата се осъществява в четири фази, които са показани на горната схема. Първоначално фагоцитът се приближава към микроорганизма или чуждото тяло под действието на хемотаксичните фактори и на системата на комплемента. След това фагоцитът прилепва къмагента, при което важен момент представлява опсонизацията на бактериите и частиците чрез серумните фактори (IgG, термолабилните фактори на С3 - фрагмента на комплемента). Този феномен се съпровожда със силно повишаване на нивото на метаболитните процеси - усилване на аеробната и анаеробната гликолиза и увеличено поглъщане на кислород, така нареченият метаболитен взрив. Той се съпровожда от дегранулация на неутрофилите и отделяне на лизозомални ензими в полето на възпаление. През третата фаза частиците се поглъщат - това става чрез инвагинация на клетката, която впоследствие се затваря и бактерията или друг вреден агент попада във вакуола или така наречената фагозома. Първоначално с нея се сливат специфичните гранули на неутрофилния левкоцит, а след това и азурофилните и се образува фаголизозома. Последният етап е вътреклетъчното смилане на фагоцитираните частици чрез хидролитичните ензими на фаголизозомата - кисела фосфатаза, аминопептидаза, катепсин, арилсулфатаза. Вътреклетъчното смилане на фагоцитираните частици изисква предварителното бактерицидно действие на миелопероксидазната система на катионните неензимни белтъци на азурофилните гранули и лизозима. Единствено загиналите бактерии се подлагат на смилане.
Неутрофилните левкоцити се наричат още микрофаги - те се явяват първи в огнището на възпаление и осигуряват така наречената първа линия на защита. Същевременно те са и клетките с най-голямо участие във възпалителната реакция. В основата на гнойното възпаление и особено при абсцеси и флегмони доминирането им в ексудата е важен морфогенетичен белег. При обилна инфилтрация на тъканта с неутрофилни гранулоцити настъпва протеолитичен разпад поразения участък и се образува гной, състояща се от загинали левкоцити със сбръчкани ядра. Това са така наречените гнойни телца, изпълващи абсцесните кухини.
Макрофагите са други клетъчни елементи, които са постоянен компонент на възпалителната реакция. Те се отнасят към клетките на моноцитно - макрофагиалната система и имат най-общо хематогенен произход. Те притежават изключително висока фагоцитарна активност, за осъществяването на която съдържат различни ензими и притежават структури за изработването им.
Макрофагите са хетерогенна група клетки. В зависимост от тяхната органна или тъканна локализация се различават монобласти и промоноцити (те се откриват в костния мозък), моноцити (те циркулират в кръвта) и тъканни макрофаги - те са разпръснати из тъканите и са разнородна група клетки. Към тях спадат хистиоцитите на съединителната тъкан, купферовите клетки в черния дроб, алвеоларните фагоцити в белодробния паренхим, фиксираните макрофаги в слезката и лимфните възли, плевралните и перитонеалните макрофаги в серозните кухини, остеокластите в костната тъкан и невроглиалните клетки в нервната тъкан. Макрофагите се разглеждат още като свободни и фиксирани - свободните могат да се придвижват и се появяват във всички тъкани, докато фиксираните са относително постоянни.
Всички различни типове макрофаги имат свои хистологични белези. Така например хистиоцитите са овални или окръглени клетки с бобовидни или вдлъбнати ядра. Макрофагите на серозните обвивки са кръгли клетки с овални ядра и много наподобяват лимфоцити. Белодробните (алвеоларни) макрофаги са доста големи, изпълващи понякога цялата алвеола, но се откриват и в интерстициалната съединителна тъкан на междуалвеоларните прегради. Макрофагите на възпалителния инфилтрат и ексудата са главно с моноцителн произход - от мигриращи в полето на възпаление кръвни моноцити. Към тях се добавят и мобилизираните в огнището на възпалението местни хистиоцити. Купферовите клетки са големи, разположени в чернодробните синусоиди, понякога проминират в лумена им. Богати са на митохондрии, лизозоми, имат добре развит апарат на Голджи и висока фагоцитарна активност. Произходът им не е окончателно изяснен - смята се че възникват от костномозъчни предшественици или от рециркулиращите клетки на лимфната тъкан. Не е изключена и възможността да се възстановяват чрез деление на място.
Макрофагите на слезката са разположени в червената пулпа и съвсем малко в бялата. Съдържат много лизозоми. Подобна характеристика имат и макрофагите на костния мозък, разположени обикновено в центъра на група от еритробласти. Освен голямото количество лизозоми в цитоплазмата им се открива и феритин.
Макрофагите в лимфните възли са с така наречените хистиоцитарни (ретикулни) клетки, богати на кисела фосфатаза, лизозоми и фаголизозоми. Пръснати са сред останалите клетки подобно на звездно небе и произхождат от моноцитите. Микроглиалните клетки произхождат от стволовите клетки на костния мозък и при нормални условия се разполагат в нервната тъкан.
Синовиалните хистиоцити активно се включват при възпалението на ставната обвивка и освобождават лизозомални хидролази, вреждащи подлежащата съединителна тъкан. При това се включват автоимунни механизми и се задлъбочава възпалителният процес - това е особено силно изразено при ревматоидния артрит.
Остеокластите са макрофагите на костната тъкан. Те са много големи, многоядрени клетки, чиято цитоплазма е богата на лизозомални ензими, с помощта на които се осигурява активна фагоцитоза и остеоклазия - разрушаване и резорбция на костната тъкан. Остеокластите се формират от кръвните моноцити чрез сливането им и фиксирайки се в костната тъкан, придобиват специфични особености. С тях се свърза и разрушаването на хрущяла.
Между макрофагите и другите мезенхимни клетки, както и между тях и другите органноспецифични клетки съществуват сложни взаимодействия, поддържащи едно динамично равновесие. Където и да се намират макрофагите (свободни или фиксирани), те проявяват своята висока фагоцитарна и пиноцитозна активност чрез същите механизми, които се наблюдават и при неутрофилните гранулоцити. Те поглъщат и смилат бактерии, но също така и остатъци от загинали клетки, от разрушения междуклетъчен матрикс, фибрин и чужди тела. Макрофагите участват в антивирусната защита на организма, за която голямо значение има продукцията на интерферон. подтискащ вирусната репликация в атакуваните клетки. Макрофагите активно участват и в имунния отговор - по повърхността си те имат рецептори за IgG и С3 - фракцията на системата на комплемента. По този начин те се свързват с антигена, след което поглъщат фиксирания вече антиген в цитоплазмата си чрез пиноцитоза и го разрушават. Макрофагите се появяват малко по-късно в огнището на възпаление в сравнение с неутрофилните гранулоцити и поради това осигуряват втората линия на защита срещу онези бактерии и вируси, с които микрофагите не са в състояние да се справят.
Еозинофилните гранулоцити се откриват значително по-малко в периферната кръв в сравнение с неутрофилите - в рамките на 1 - 3 %. Гранулите им съдържат белтъци, липиди, ензими, особено оксидази и пероксидази. Предшественици в костния мозък са еозинофилните миелоцити. Еозинофилия в кръвта се наблюдава при различни хелминтози, алергични заболявания, медикаментозна алергия и други. Еозинофилните гранулоцити винаги се откриват във възпалителния инфилтрат, като в някои случаи са доминирщата клетъчна популация - при алергичен ринит, бронхиална астма, синдром на Льофлер, алергични васкулити, миокардити, около паразити и т.н. За възникването на еозинофилията има значение един медиатор - еозинофилният хемотаксичен фактор, който се произвежда от базофилните клетки и мастоцитите. Под влияние на различни стимулатори, в това число IgG и системата на комплемента, настъпва дегранулацията на еозинофилите с отделянето на катионни белтъци и пероксидази, които осигуряват основната им функция - фагоцитозата. Освен това тези клетки стимулират повишено образуване на имуноглобулин тип Е от плазмоцитите, с което се включват като ефекторни клетки в огнището на възпаление, особено при алергични реакции. Еозинофилите са в състояние да фагоцитират комплекси антиген - антитяло, еритроцити, бактерии, гъби, могат да убиват и паразити.
Базофилните гранулоцити са най-малочислени - 0.5 - 1 % от всички левкоцити. Диференцират се от клетките - предшественици в костния мозък, като специфичните им гранули се появяват рано в процеса на левкопоеза. Смята се че базофилните левкоцити са предшественици на тъканните баофилни клетки (мастоцитите), които са намират често и в голямо количество в базофилния инфилтрат. Базофилите веднага след действието на увреждащия агент се дегранулират и освобождават едни от най-вазоактивните медиатори на възпалението - хистамин, хепарин и серотонин. От тях се отделя еозинофилният хемотаксичен фактор, активиращият тромбоцитен фактор и бавнореагиращата субстанция на анафилаксията. По повърхността на базофилите има специфични рецептори за имуноглобулин Е. Този тип имуноглобулин се свързва с мембраната на базофила и при въздействие на алерген се стига до масивна дегранулация. Този процес се стимулира допълнително от еозинофилите, особено при състояние на хиперсенсибилизация.
Матоцитите са едни от основните източници на химични медиатори на възпалението. Разполагат се навсякъде в рехавата съединителна тъкан, перивазално или близко до жлезите и епител на лигавиците. Гранулите им са изпълнени с хистамин, серотонин и хепарин. Цитоплазмата им е богата на кисела фосфатаза, алкална фосфатаза, пероксидази, аденозинтрифосфатаза левцинаминопептидаза и други. На повърхността им, както беше вече описано, са разположени множество рецептори за имуноглобулин Е, при свързването на които с антиген - антитяло комплекси се извършва дегранулация на мастоцитите с всички физиологични и патофизиологични последици от това.
Произходът на мастоцитите все още не е изяснен. Според някои автори това са клетки, които произхождат от базофилните гранулоцити, а според други това са големи лимфоцити. В зрелите, изпълнени с гранули мастоцити, рядко се откриват митози. Вероятно мастоцитите увеличават своя брой не чрез деление, а чрез трансформация на клетки - предшественици.
В областта на хроничното възпаление също се срещат специфични видове клетки. Лимфоцитите се откриват почти винаги - те са индикатори за имунния характер на възпалителния отговор. Те са малки клетки, с диаметър около 6 микрометра, с оскъдна цитоплазма, която се изпълва с окръглено ядро. Те преминават през капилярната стена по-късно, след неутрофилните левкоцити и моноцитите, и то значително по-трудно. Лимфоцитите в колаборация с макрофагите осъществяват реакциите, свързани с клетъчния и хуморалния имунитет. Описани са два типа - В - лимфоцити (бурсозависими) и Т - лимфоцити (тимусозависими). И двата типа се формират в костния мозък, след което, поради генетична детерминираност, окончателно се заселват в Т- и В-зависимите зони на лимфоидните органи (слезка и лимфни възли). При антигенно стимулиране лимфоцитите се активират и настъпва бластна трансформация, размерът на клетките нараства до около 20 микрометра, цитоплазмата става по-обилна и по-богата на органели. Ядрото увеличава размера си, а в ядърцето нараства съдържанието на РНК.
В - лимфоцитите имат на повърхността си имуноглобулинови рецептори. Зрелите, бластно - трансформирани В - лимфоцити в морфо - функционално отношение се явяват предшественици на плазмобластите и плазмоцитите, които секретират имуноглобулини. Т-лимфоцитите формират няколко субпопулации - Т - хелпери, подпомагащи В - лмфоцитите в техния имунен отговор, Т - супресори и Т - килъри, които съответно осигуряват подтискащо В - лимфоцитната пролиферация или имат цитолитично действие спрямо вредния агент или другите клетки. При активиране Т - лимфоцитите преди всичко отделят биологичноактивни субстанции (медиатори) - така наречените лимфокини. Те имат отношение към процеса на фагоцитоза (активират макрофагите), повишават съдовия пермеабилитет или стимулират антитялообразуването. Освен това лимфокините имат и цитотоксичен ефект върху някои бактерии, вируси, гъби, но понякога и върху собствените клетки на организма.
Друг важен клетъчен компонент на хроничното възпаление са плазмоцитите. Те произхождат от трансформираните В - лимфоцити на лимфните възли и костния мозък. Имат характерен микроскопски изглед - диаметър около 18 микрометра, широка, базофилна, богата на РНК цитоплазма и ексцентрично разположено ядро, със светло хало около него и плътен, особено разпределен хроматин като спици на колело. Функционалната активност на плазмоцитите е висока - те синтезират голямо количество имуноглобулини, имат силно развит зърнест ендоплазмен ретикулум и апарат на Голджи, както и много рибозоми. При достатъчен титър на антителата може да се предотврати развитието на възпаление или да се атенюира неговото действие, след което се развива хроничен възпалителен отговор. Освен това плазмоцитите чрез продуцираните от тях имуноглобулини играят роля в опсонизацията на бактериите или частиците, с което благоприятстват процеса на фагоцитоза.
Епителоидните клетки също се откриват в огнището на хронично възпаление и се възприемат като видоизменени макрофаги. Характерни са за хроничното възпаление и главно за неговите специфични форми. Участват във формирането на грануломите. Морфологично показват прилика с клетките на многослойния плосък епител, откъдето идва и наименованието им. Имат обилна, светла цитопоплазма и удължено, а в други случаи бъбрековидно ядро, централно или ексцентрично разположено. Цитоплазмата им е богата на клетъчни органели - митохондрии, много рибозоми, силно развит зърнест ендоплазматичен ретикулум и апарат на Голджи. Епителоидните клетки осигуряват фагоцитарна активност, но в значително по-малка степен в сравнение с макрофагите. Могат да се трансформират във фибробласти, синтезиращи колаген и други белтъчни молекули.
При затруднения в процеса на фагоцитозата, обусловени от големината и характера на увреждащия агент, недостатъчност на ензимните системи или други фактори, в полето на хроничното възпаление се явяват гигантски клетки. Те са многоядрени, като в някои случаи могат да съдържат до 100 ядра. Гигантските клетки са резултат от сливането на макрофагите или на епителоидните клетки под влияние на макрофагеалния сливащ фактор - той се отделя от активираните Т-лимфоцити. Смята се че при сливане на макрофагите се получават гигантски клетки тип чуждо тяло, а при сливане на епителоидните клетки - гигантски клетки тип Лангханс. Първите са много големи, с диаметър до около 100 микрометра, с неправилна форма, с кръгли или овални ядра, безразборно пръснати в цитоплазмата. Разполагат се в непосредствена близост до чуждото тяло. Гигантските клетки тип Лангханс са окръглени, с удължени или бъбрековидни ядра, разположени в единия край на клетката под формата на подкова или полулуние. Характерни са за туберкулозното възпаление и се разполагат около огнището на казеозна некроза, като подковите или полулунията са отворени към некротичния център.
Около огнища на стеатонекроза, холестеринови или уратни кристали, рогово вещество или пигменти се формират друг тип гигантски клетки - така наречените клетки на Тутон. Това са многоядрени, с неправилна форма клетки, които са разположени почти централно, около малка, плътна цитоплазмена зона. Около тях цитоплазмата е много светла и е натоварена с липиди.
Понякога в цитоплазмата на всички гигантски клетки могат да се открият фагирани бактерии, различни субстанции, частици или кристали.
Освен локалните прояви в тъкани и органи, възникващи в хода на острото и хроничното възпаление, възпалителната реакция се съпровожда и от системни, общи прояви от страна на макроорганизма. Важна такава манифестация е локалната реакция от страна на лимфните възли, дрениращи съответната на възпалението област. Първоначално възниква лимфангит, а след това и лимфаденит. Те представляват или неспецифичен отговор спрямо медиаторите, освобождавани от увредените тъкани, или са специфична реакция, респективно имунен отговор спрямо чуждия антиген. Възпалението на лимфните съдове в кожата се представя под формата на червени ивици, а регионалните лимфни възли са увеличени и болезнени. Хистологично в стената на съдовете се наблюдава възпалителен инфилтрат, лимфостаза, а в лимфните възли фоликуларна хиперплазия и пролиферация на мононуклеарните фагоцити в синусите - синусна хистиоцитоза. В други случаи може да се развие дори гноен лимфаденит.
Друга системна клинична проява на възпалението е фебрилитетът (треската). Пирогените, освобождавани в циркулацията, предизвикват треската и от една страна са с екзогенен произход - от бактериите, но от друга има и ендогенни медиатори - например интерлевкин 1. Той се секретира първично от макрофагите в резултат от фагоцитни стимули или от бактериалните ендотоксини и вирусите. Този интерлевкин въздейства върху центъра на терморегулацията в хипоталамуса и инициира повишаване на телесната температура. Освен това той стимулира метаболизма на арахидоновата киселина (също в хипоталамуса) с последваща секреция на простагландини, които имат същия ефект. Инхибиторите на циклооксигеназата (например аспирин) блокират треската чрез инхибиране на интерлевкин - 1 стимулираната секреция на простагландини в хипоталамуса. Повишаването на телесната температура е полезна физиологична реакция при наличие на възпаление - доста бактерии и вируси умират бързо при един или два градуса по-висока темепратура. Същевременно при повишаване на температурата общият тонус на организма намалява и работоспособността се понижава; това само по себе си не е патологична реакция, а само компенсаторен механизъм. При температури над 42 градуса по Целзий обаче може да се стигне до хипертермичен гърч (особено при деца), което вече представлява патофизиологичен механизъм - още един пример за несъвършенството на човешкия организъм.
Друг системен ефект на възпалението е левкоцитозата - увеличено количество на левкоцитите в системното кръвообръщение. Увеличава се най-вече количеството на неутрофилните гранулоцити в периферната кръв. Появяват се и млади, незрели форми полиморфонуклеарни левкоцити. Това се дължи на действието на специфични медиатори, които провокират пролиферацията - стимулиращи колонизацията фактори.
В някои случаи увеличението на левкоцитите и на незрелите им форми в периферната кръв може да достигне изключително високи стойности - от порядъка на 40 000 до 100 000 за милилитър, което е подобно на увеличението при левкозите. Това се означава с термина левкемоидна реакция и трябва да се диференцира от истинската левкемична реакция. Основен белег се явява морфологията на клетките, които при левкемоидната реакция са млади, незрели форми без други патологични белези. При левкозите клетките са туморно изменени - налице е бластна трансформация.
Левкоцитозата е белег, характерен основно за бактериалните инфекции. Обратно, вирусите предизвикват предимно увеличение на на лимфоцитите в периферната кръв - лимфоцитоза. При паразитни инфекции и паразитни възпалителни реакции пък се наблюдава еозинофилия - еозинофилите достигат 10 - 15 % от клетките при норма 1 - 3 %.
При някои протрахирани хронични инфекции може да се наблюдава левкопения. Механизмите, по които протича подтискането на левкопоезата, не са напъно изяснени. Предполага се че настъпва дисбаланс в продукцията на медиаторите, регулиращи съзряването на миелоцитните и лимфоцитните прекурсори в костния мозък. Разбира се, значение има и състоянието на декомпенсация, в която изпада организмът при продължителни заболявания - изконсумират се хранителните ресурси и нови клетки и молекули се синтезират по-трудно.